DAS Salzhydrolyse zwischen starken Säuren und Basen es tritt auf, wenn das Kation in einem Salz nicht mit dem Anion in Wasser wechselwirkt und das Anion im Salz nicht mit dem Kation in Wasser wechselwirkt. Hydrolyse zwischen Kationen und Anionen eines Salzes und Wasser tritt nur auf, wenn das gebildete Produkt eine schwache Säure, eine schwache Base oder beides ist. Verstehen Sie Schritt für Schritt die Salzhydrolyse zwischen starken Säuren und starken Basen:
a) Schritt 1: Wasserionisation
Wasser ist ein Stoff, der leiden kann Autoionisierung, d. h. es erzeugt ein Hydronium-Kation (H+) und Hydroxid-Anion (OH-) von seiner Struktur.
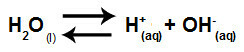
Gleichung, die die Selbstionisierung von Wasser darstellt
b) Schritt 2: Dissoziation aus Salz
Wenn ein Salz zu Wasser hinzugefügt wird, durchläuft es den Dissoziationsprozess. Da Salz eine ionische Verbindung ist, werden in Wasser seine Kationen und Anionen in das Medium freigesetzt, wie in der folgenden Gleichung gezeigt:
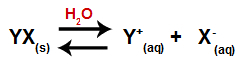
Gleichung, die die Dissoziation eines beliebigen Salzes darstellt
c) Schritt 3: Salzhydrolyse starker Säuren und Basen
Bei starker Säure: wenn das Anion des Salzes mit dem H+ Wasser, um HCl, HBr, HI oder eine andere Säure zu bilden, bei der die Subtraktion der Anzahl der Sauerstoffe durch die Anzahl der Wasserstoffe gleich oder größer als 2 ist, erhalten wir starke Säure. Daher tritt die Kombination zwischen den genannten Ionen nicht auf.
Für ein starkes Fundament: wenn das Kation des Salzes der Familie IA (Alkalimetalle) oder IIA (Erdalkalimetalle außer Magnesium) mit dem OH. kombiniert wird- Wasser, es bildet sich a starkes Fundament. Daher tritt die Kombination zwischen den genannten Ionen nicht auf.
Wenn Salzionen nicht mit Wasserionen interagieren, haben wir die folgende Gleichung:
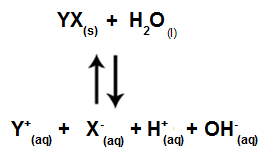
Gleichung, die alle in der Lösung vorhandenen Ionen anzeigt
Zusammenfassend, da die Salzionen nicht mit den Wasserionen wechselwirken, fördern die Salzionen keine Veränderung in der endgültigen Lösung. Somit können wir die Gleichung einer Salzhydrolyse zwischen starken Säuren und starken Basen nur mit der Wasserionisationsgleichung schreiben.
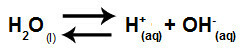
Gleichung für die Hydrolyse starker Säuren und Basen
d) Beispiel einer Salzhydrolyse zwischen starken Säuren und Basen
Wenn wir das Kaliumchloratsalz in Wasser geben (KClO3), dissoziiert das Salz und setzt das Kaliumkation (K+) und das Chloratanion (ClO3-) mitten drin.
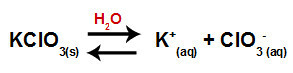
Dissoziationsgleichung für Kaliumchlorat
Es ist wichtig, sich daran zu erinnern, dass Wasser eine Selbstionisierung erfährt und das Medium mit Hydroniumkation (H+) und Hydroxid-Anion (OH-). Wir müssen nun die Wechselwirkung zwischen Salz- und Wasserionen beurteilen.
Wenn das H+ interagiert mit ClO3-, es bildet Perchlorsäure (HclO3). Da die Subtraktion der Zahl der Sauerstoffe durch die Zahl der ionisierbaren Wasserstoffe in Perchlorsäure 2 beträgt, ist sie stark. Daher tritt die Wechselwirkung zwischen den Ionen nicht auf.
Wenn das K-Kation+ interagiert mit dem OH-Anion-,wir haben die Bildung einer starken Base, da Kalium ein Alkalimetall ist. Daher tritt die Wechselwirkung zwischen den Ionen nicht auf.
Die Gleichung, die die Salzhydrolyse zwischen starken Säuren und Basen aus der Auflösung von Kaliumchlorat in Wasser darstellt, lautet:
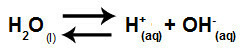
Chemische Gleichung der Kaliumchlorat-Hydrolyse
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm


