Energieoxidation in Alkine ist eine organische Reaktion, die auftritt, wenn ein Alkin (ein Kohlenwasserstoff mit einer Dreifachbindung zwischen zwei Kohlenstoffatomen) zu einer sauren Lösung mit dem with Reagenz von baeyer (Kaliumpermanganat - KMnO4).
HINWEIS: Eine Reaktion von Energieoxidation kann mit Kaliumdichromat (K2Cr2Ö7) und nicht nur Kaliumpermanganat.
Immer wenn eine Reaktion von energetische Oxidation in Alkinen durchgeführt wird, die Produkte, die entstehen können, sind Carbonsäuren, Wasser (das einzige Element, das in einem von ihnen vorkommt) und Kohlendioxid (CO2).
Baeyer Reagenz in saurem Medium
Wenn Baeyers Reagenz mit Wasser vermischt wird, in Gegenwart von a Acid (Stoff, der H-Ionen freisetzen kann+), die Bildung von zwei Oxide (Kaliumoxid und Manganoxid II) und naszierende Sauerstoffe ([O]).

Mechanismen der Energieoxidation in Alkinen
1. Mechanismus: die Dreifachbindung brechen.
Anfänglich wird die Dreifachbindung von naszierenden Sauerstoffen angegriffen, die durch Baeyers Reagenz gebildet werden. Durch diesen Angriff wird die Dreifachbindung vollständig gebrochen.
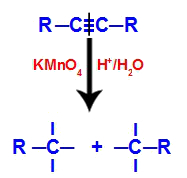
Störung der Dreifachbindung durch Angriff naszierender Sauerstoffe
Beim Aufbrechen der Dreifachbindung wird das Alkin in zwei Teile gespalten. An jedem der dreifach gebundenen Kohlenstoffe erscheinen drei freie Valenzen.
2. Mechanismus: Wechselwirkung von Hydroxylgruppen
Jede der freien Valenzen an den Kohlenstoffatomen, an denen die Dreifachbindung war, wird von Hydroxylgruppen (OH) besetzt, wodurch ein Polyol entsteht (Alkohol mit mehreren Hydroxylen).
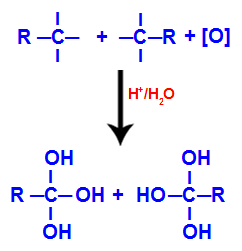
Bildung von Polyol mit Hydroxylgruppen nach Spaltung der Dreifachbindung
HINWEIS: Wenn an den Kohlenstoff, an dem sich früher die Dreifachbindung befand, ein Wasserstoffatom angebracht ist, erhält dieses Wasserstoffatom einen entstehenden Sauerstoff und bildet auch ein weiteres Hydroxyl.
3. Mechanismus: Bildung von Wassermolekülen
Wenn ein Kohlenstoff zwei oder mehr OH-Gruppen aufweist, wird er aufgrund der Anwesenheit von extrem Elektronegative. Aufgrund der Instabilität dehydriert das Molekül also selbst, d. h., ein Hydroxyl bindet an Hydronium (H+) aus einem anderen Hydroxyl und bildet Wasser.

Bildung von Wassermolekülen aus zwei im gebildeten Polyol vorhandenen Hydroxylen
4. Mechanismus: Produktbildung
Nach der Bildung von Wassermolekülen verliert der Kohlenstoff durch den Austritt von a. eine Bindung Hydroxyl, und der Sauerstoff des anderen Hydroxyls verliert ebenfalls eine Bindung, die mit a Wasserstoff. Daher tritt zwischen diesem Kohlenstoff und Sauerstoff eine Doppelbindung auf, die ein Carbonyl (C=O) bildet und beide stabilisiert.
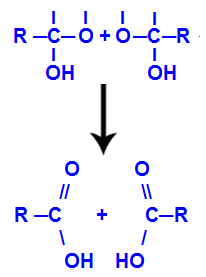
Carbonylbildung in den beiden aus Alkinen erhaltenen Strukturen
Beispiel für eine Alkin-Energie-Oxidationsgleichung
Beispiel: Energetische Oxidation von But-1-ino
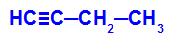
Strukturformel von But-1-in
Wenn But-1-in in ein Medium gegeben wird, das Bayers Reagens, Wasser und Säure enthält, bricht die Bindung. Dreifach vorhanden zwischen den Kohlenstoffen 1 und 2, aufgrund des Angriffs der entstehenden Sauerstoffe, die in der Mitte vorhanden sind, wie in der Gleichung unten:
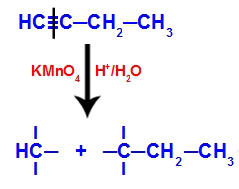
Aufbrechen der But-1-in-Verbindungen
Nachdem die Dreifachbindung gebrochen ist, erhalten die Kohlenstoffe 1 und 2 drei Hydroxyle, aber Kohlenstoff 1 wird noch eins haben, weil es hatte ein Wasserstoffatom (das an einen entstehenden Sauerstoff bindet) und bildete zwei Polyole (Fragment 1 und 2).

Gleichung für die Bildung von Polyolen
Da Polyole instabil sind, bilden sich bald Wassermoleküle aus den Hydroxylen. In Fragment 1 erscheint ein Wassermolekül (weil es drei Hydroxyle gibt) und in Fragment 2 erscheinen zwei Moleküle (weil es vier Hydroxyle gibt).
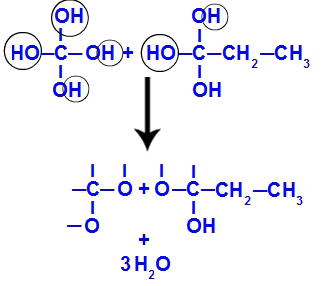
Bildung von Wassermolekülen aus But-1-in-Fragmenten
Schließlich haben wir die Bildung der Doppelbindung zwischen den Kohlenstoffen, die Hydroxyl verloren haben, und den Sauerstoffen, die Wasserstoff verloren haben, wodurch Carbonyle entstehen.

Bildung von Carbonylen in den But-1-in-Fragmenten
Mit der obigen Gleichung können wir sehen, dass But-1-in eine Carbonsäure und Kohlendioxid (CO2).
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm
