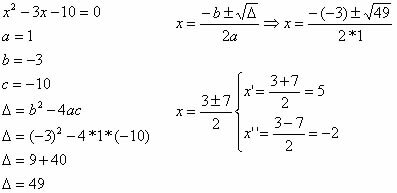Nitroverbindung ist eine organische Verbindung, die aus der chemischen Reaktion zwischen Salpetersäure (HNO3) es ist ein alkan (offenkettiger gesättigter Kohlenwasserstoff) oder ein Aromat. Wenn Salpetersäure mit Alkanen reagiert oder aromatisch, tritt eine Substitutionsreaktion auf, bei der die Säure eine Hydroxylgruppe (OH) verliert und die organische Verbindung einen Wasserstoff verliert:
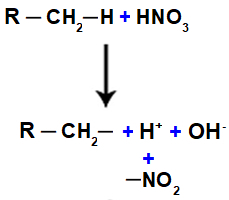
Als nächstes haben wir die Bildung eines Wassermoleküls, das aus der Vereinigung von OH und H resultiert, während die KEINE Gruppe2 (das von der Säure übrig bleibt) bindet an das Alkan oder Aromat und bildet die Nitroverbindung.
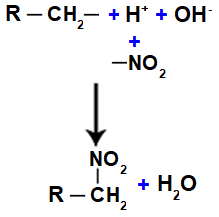
Darstellung von Wasser- und Nitroverbindungsbildung
Somit ist das Hauptstrukturmerkmal von a Nitroverbindung ist die Anwesenheit von einem oder mehreren Nitrogruppen (BEI DER2) an ein Alkan oder einen Aromaten gebunden.
Eigenschaften
In Gedenken an Eigenschaften physisch können wir hervorheben:
Im Allgemeinen handelt es sich bei Raumtemperatur um viskose Flüssigkeiten (mit Ausnahme von Nitroverbindungen mit niedriger Molmasse, die flüssige Flüssigkeiten sind);
Sie haben hohe Schmelz- und Siedepunkte;
Sie sind dichter als Wasser;
Im Allgemeinen sind sie wasserunlöslich, mit Ausnahme von Nitromethan und Nitroethan;
Aus einer aliphatischen Kette gebildet, haben sie ein angenehmes Aroma und sind nicht giftig. Wenn sie nun von einer aromatischen Kette gebildet werden, sind sie giftig und haben ein unangenehmes Aroma;
Ö Art der intermolekularen Kraft das seine Moleküle vereint ist das permanenter Dipol, da sie polare Eigenschaften haben.
Was die chemischen Eigenschaften betrifft, müssen wir wissen, dass die Nitroverbindungen sie sind sehr reaktiv, das heißt, sie werden in verschiedenen organischen Reaktionen, wie beispielsweise Substitutionsreaktionen, verwendet.
Die offizielle Nomenklaturregel, vorgeschlagen von der IUPAC (International Union of Pure and Applied Chemistry), für Nitroverbindungen é:
Nitro + Präfix + Infix + Aus
Hinweis: Das Präfix bezieht sich auf die Anzahl der Kohlenstoffe, die in der Nitroverbindungskette vorhanden sind. Das Infix bezieht sich auf die Art der Bindungen zwischen den Kohlenstoffen.
Beispiele:
Nomenklatur einer normalkettigen Nitroverbindung

Zunächst ist es interessant, die Zeichenfolge von zu nummerieren Nitroverbindung (immer von dem Kohlenstoff, der dem Kohlenstoff am nächsten ist, der die Nitrogruppe hat):
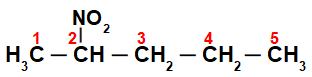
Durch die Nummerierung der Zeichenfolge der Nitroverbindung, wir haben, dass darin fünf Kohlenstoffatome (Präfix pent) sind, nur Einfachbindungen zwischen den Kohlenstoffen (Infix an) und der Nitrogruppe an Kohlenstoff 2. Der Name dieser Struktur ist 2-Nitropentan.
Nomenklatur einer normalkettigen Nitroverbindung
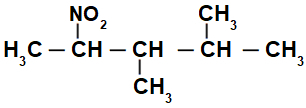
Strukturformel einer verzweigten Nitroverbindung
Zunächst ist es interessant, die Zeichenfolge von zu nummerieren Nitroverbindung (immer vom Kohlenstoff, der dem Kohlenstoff mit der Nitrogruppe am nächsten ist) bis zum Ende mit der höchsten Kohlenstoffzahl für die Hauptkette:
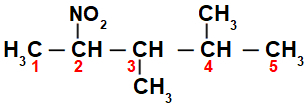
Durch die Nummerierung der Zeichenfolge der Nitroverbindung, haben wir, dass darin 5 Kohlenstoffatome (Präfix pent), nur Einfachbindungen zwischen den Kohlenstoffen (Infix an), zwei Methylradikale (an den Kohlenstoffnummern 3 und 4) und die Nitrogruppe an Kohlenstoff 2 enthalten sind. Der Name dieser Struktur ist 3,4-Dimethyl-2-nitropentan.
Verwendet
Sie Nitroverbindungen, im Allgemeinen können sie bei der Herstellung von Pestiziden, Farbstoffen, Anilin, Bakteriziden, Fungiziden, Zusatzstoffen, Lösungsmitteln verwendet werden; sie wirken auch als Sprengstoff und in der Ölraffination.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-nitrocomposto.htm