Normalerweise sind die Reaktionen von wässrige Elektrolyse und Eruptivelektrolyse sie werden mit Graphit- und Platinelektroden durchgeführt, die nicht an der Reaktion teilnehmen; sie leiten nur elektrischen Strom. Es gibt jedoch einige spezifische Fälle, in denen es notwendig ist, zu verwenden aktive Elektroden, d. h., die einer Reduktion und Oxidation unterliegen.
Die Hauptanwendungsfälle dieser am Redoxprozess beteiligten Elektroden sind: a elektrolytische Metallreinigung, wie Zink, Kobalt, Nickel und hauptsächlich Kupfer; und auch die Galvanisieren. Sehen wir uns an, wie jeder Fall auftritt:
• Kupferelektrolytische Reinigung: Diese elektrolytische Kupferraffination kann eine Reinheit von ca. 99,9 % erreichen und wird hauptsächlich zur Herstellung verwendet Kupferdrähte, die bei geringster Verunreinigung sehr elektrischen Strom leiten können vermindert.
Beobachten Sie, wie dieser Prozess abläuft, indem Sie das Schema eines unten zusammengebauten Elektrolytbehälters sehen:

An die wässrige Kupfersulfatlösung (CuSo .) wird eine Potentialdifferenz angelegt
4 (wässrig)) – die Elektrizität leitet –, so dass die Anode, die ein unreines metallisches Kupfer ist, Elektronen verliert, d. h. oxidiert und ihre Kationen (Cu2+), die auf der Negativplatte abgeschieden werden. Dies könnte eine inerte Platinplatte oder besser eine reine Kupferplatte sein. Es bildet die Kathode, die durch die Abscheidung von Kupfer reduziert wird. Somit sind die Halbreaktionen, die in den Elektroden auftreten: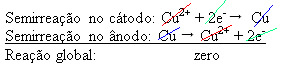
Die Tatsache, dass es ein Ergebnis von Null ergab, deutet darauf hin, dass keine chemische Reaktion, sondern nur der Transport von Kupfer stattgefunden hat. Am Boden des Behälters befinden sich die anderen unreinen Stoffe, die in Kupfer enthalten waren, wie Gold, Silber, Kieselsäure (Sand) und andere Mineralien, die sogar verkauft werden können.
• Galvanisieren: Auf ein Material, das vor Korrosion geschützt werden soll, wird eine metallische Beschichtung aufgebracht.
Das für die Beschichtung gewählte Metall - das kann Chrom (Chrom), Nickel (Nickel), Silber (Silber), Gold (Vergoldung) oder Zink (Galvanisierung) – ist die Anode, positive Elektrode, die oxidiert wird und Elektronen verliert. Es wird anstelle des geschützten Materials oxidiert, da sein Reduktionspotential höher ist.
Die negative Elektrode, also die Kathode, die diese Elektronen aufnimmt und reduziert wird, ist das beschichtete Material selbst. Auf diese Weise bleibt es auch dann geschützt, wenn seine Oberfläche irgendwie verletzt wird.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm


