das chemische Element Phosphor (P) gehört zur dritten Periode des Periodensystems und zur Stickstofffamilie (VA). Aus diesem Grund machen seine Atome normalerweise drei chemische Bindungen um die zu erreichen Oktetttheorie (Stabilität). Es gibt jedoch Situationen, in denen ein Phosphoratom mehr als drei Bindungen eingeht, was nur durch die Hybridisierungsphänomen.
Um das zu verstehen Phosphorhybridisierung, wir müssen zuerst verstehen, warum das Atom dieses Elements drei Bindungen eingeht. Dazu müssen wir lediglich Ihre elektronische Verteilung überwachen:

Elektronische Phosphorverteilung
Wir können beobachten, dass das Phosphoratom in der Valenzschicht das komplette 3s-Unterniveau hat (mit zwei Elektronen) und das unvollständige 3p-Unterniveau (jedes der drei p-Unterniveau-Orbitale hat a Elektron). Unten haben wir die Verteilung der Elektronen in den Orbitalen der Unterniveaus des Phosphor-Valenzschicht:
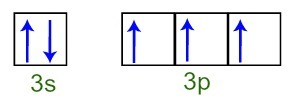
Darstellung der Valenzschalenelektronen des Phosphoratoms
Da jedes der 3p-Sublevel-Orbitale unvollständig ist, kann das Phosphoratom drei chemische Bindungen eingehen, wodurch Stabilität erreicht wird.
Betrachten wir nun die Substanz PCl5zum Beispiel sind wir sicher, dass in diesem Molekül der Phosphor eine Hybridisierung durchmachte, da er fünf Verbindungen herstellte. Denn Chlor, das zur VIIA-Familie gehört, braucht eine Bindung, um stabil zu sein und das Molekül hat davon fünf Atome Element, jeder von ihnen muss eine Bindung eingehen, wodurch das Phosphoratom wiederum auch fünf bilden muss Verbindungen. Dieses Auftreten ist nur möglich durch die Hybridisierung (Vereinigung unvollständiger Atomorbitale) von Phosphor.
Bei der Aufnahme von Energie aus der äußeren Umgebung werden die Elektronen des Phosphoratoms angeregt. Kurz darauf wandert eines der beiden Elektronen des 3s-Unterniveaus auf ein leeres Orbital des d-Unterniveaus, das bis dahin keine Elektronen besitzt. Siehe das Diagramm unten:
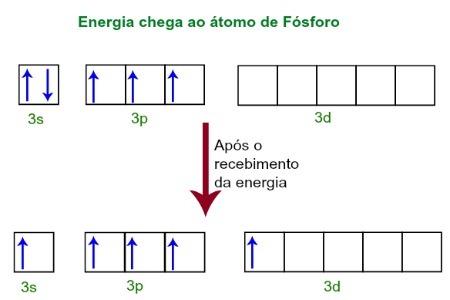
Beim Empfang von Energie werden die Elektronen des Leuchtstoffs angeregt und man nimmt ein Orbital der d-Unterebene ein.
In diesem Moment haben wir in der Valenzschicht des Phosphors ein s-Orbital, drei p-Orbitale und ein unvollständiges d-Orbital.Letztendlich hybridisieren diese fünf Orbitale, das heißt verschmelzen, was zu fünf unvollständigen Atomorbitalen führt, die nun fünf chemische Bindungen eingehen können.

Hybridisierung unvollständiger Atomorbitale von Phosphor
Als s-Orbital wurden drei p-Orbitale und ein d-Orbital verbunden, die Phosphor-Hybridisierung ist vom Typ sp3d.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm


