Beim gewöhnliche Batterien werden genannt Leclanché-Batterien benannt nach seinem Erfinder, dem französischen Chemiker George Leclanché (1839-1882).

George Leclanché (1839-1882)
Leclanché hat diesen Batterietyp im Jahr 1866 entwickelt. Sie heißt auch Trockenbatterie denn bis dahin gab es nur Batterien, die wässrige Lösungen verwendeten, wie zum Beispiel Daniells Haufen.
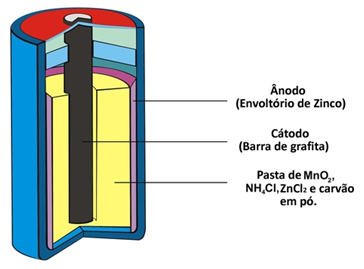
Zwei weitere Namen, die dieser Pfahltyp aufgrund seiner Beschaffenheit erhält, sind Säurehaufen oder Zink-Kohle-Batterie. Es besteht im Wesentlichen aus einer Zinkhülle, die durch ein poröses Papier von den anderen chemischen Spezies, die den Stapel bilden, getrennt ist.
Dieses Zink entspricht dem negativen Pol der Zelle oder Anode, da es oxidiert und zwei Elektronen gemäß der folgenden Halbreaktion verliert:
Minuspol - Anode: Zn (s) → Zn2+(Hier) + 2 und-
Dieser Haufen hat auch einen positiven Pol, die Kathode, ein Graphitstab, der in der Mitte des Haufens installiert ist und von Mangandioxid (MnO .) umgeben ist2), Kohlepulver (C) und eine nasse Paste mit Ammoniumchlorid (NH4Cl), Zinkchlorid (ZnCl2) und Wasser (H2Ö).
Ammoniumchlorid und Zinkchlorid sind Salze mit saurem Charakter, daher der Name „Säurezelle“.
Der Graphitstab leitet die durch Zink verlorenen Elektronen zu Mangan und reduziert Mangandioxid (MnO)2) zu Mangantrioxid (Mn2Ö3), nach folgender Halbreaktion:
Pluspol - Kathode: 2 MnO2 (wässrig) + 2 NH41+(Hier) + 2e- → 1 Mio2Ö3(s) + 2NH3(g) + 1 Stunde2Ö(1)
Die nasse Paste wirkt als Salzpunkt und ermöglicht die Migration von Hydroxylanionen (OH-) von Graphit bis Zink.
Die Gesamtreaktion ist gegeben durch:
Zn (s) + 2 MnO2 (wässrig) + 2 NH41+(Hier) → Zn2+(Hier) + 1 Mio2Ö3(s) + 2NH3(g)
Daher sind diese Batterien nicht wiederaufladbar, da das gesamte Mangandioxid in Mangantrioxid umgewandelt wird. Wenn die Batterie nicht mehr funktioniert, muss sie entsorgt werden.
Die ddp dieser Batterien beträgt 1,5 V. Ammoniak (NH3(g)) an der Kathode gebildet wird, kann sich auf dem Graphitstab ablagern, wodurch der Durchgang von Elektronen behindert und die Spannung der Batterie verringert wird. Um zum Normalbetrieb zurückzukehren, lassen Sie die Batterie einfach außerhalb des Geräts ruhen, da das Zinkkation (Zn2+(Hier)) an der Anode gebildete reagiert mit Ammoniak und lässt den Graphitstab frei.
Darüber hinaus kann auch das Ablegen des Haufens in den Kühlschrank hilfreich sein, da eine Senkung der Temperatur die Löslichkeit von Ammoniak in der feuchten Paste im Haufen begünstigt.
Ein weiterer wichtiger Faktor bei Leclanché-Trockenzellen, den wir berücksichtigen müssen, ist, dass das Zinkgehäuse kann korrodieren und dadurch das korrosive Material austreten und das Gerät beschädigen.. Daher ist es am besten, die Batterien nicht in Geräten zu belassen, die nicht ständig verwendet werden.
Trockenbatterien werden für Geräte angezeigt, die eine leichte und kontinuierliche Entladung erfordern, wie z. B. Fernbedienungen, Wanduhren, tragbare Radios und Spielzeuge.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm
