Reversible Reaktionen beginnen normalerweise mit einer bestimmten Menge an Reagenzien. Wenn die direkte Reaktion beginnt, werden diese Reagenzien im Laufe der Zeit für die Bildung verbraucht der Produkte, folglich nimmt die Konzentration der Reagenzien ab, während die Konzentration der Produkte steigt. Dann beginnt auch die inverse Reaktion, die auch die Reaktanten produziert, bis die Entwicklungsgeschwindigkeit (Geschwindigkeit) der direkten und der inversen Reaktion gleich bleibt und das sogenannte. erreicht wird chemisches Gleichgewicht.
Im Gleichgewicht gibt es die Gleichgewichtskonstante Kc, die im Wesentlichen ausgedrückt wird durch:
|
Kc = [Produkte]Koeffizient in ausgewogener chemischer Gleichung [Reagenzien]Koeffizient in ausgewogener chemischer Gleichung |
Das heißt, unter Berücksichtigung der folgenden generischen Gleichgewichtsreaktion:
a A + b B ↔ c C + d D
Da die Kleinbuchstaben die Koeffizienten und die Großbuchstaben die Stoffe sind, lautet die Gleichgewichtskonstante dieser Reaktion:
Kc = [Ç]ç. [D]d
[DAS]Das. [B]B
Näheres dazu finden Sie im Text Gleichgewichtskonstanten Kc und Kp. Dieser Text zeigt uns auch etwas Wichtiges: dass Kc-Werte uns zeigen können, ob die Konzentration der Reagenzien und die Produkte gleich sind oder wenn eines größer ist als das andere und als Folge, wenn das chemische Gleichgewicht in eine Richtung verschoben wird Reaktion.
Wir müssen also den Wert von Kc bestimmen. Denken Sie dabei daran, dass diese Berechnungen experimentell sind. Schauen wir uns also einige Beispiele für Reaktionen und die daraus gewonnenen Daten an.
Sehr hilfreich bei der Durchführung dieser Berechnungen ist es, eine Tabelle ähnlich der unten gezeigten zu schreiben und die darin genannten Schritte zu befolgen:

Tabelle zum Organisieren der Daten zur Berechnung der Gleichgewichtskonstanten
Kommen wir nun zur Praxis:
Beispiel 1: In einem geschlossenen Behälter mit einem Fassungsvermögen von 2 l bei einer Temperatur von 100°C befinden sich 20 mol N2Ö4. Die folgende reversible Reaktion beginnt abzulaufen: N2Ö4 ↔ NEIN2. Nach einiger Zeit stellte sich heraus, dass die Reaktion ein chemisches Gleichgewicht erreichte und 8 mol NO2 gebildet hatte. Welchen Wert hat die Gleichgewichtskonstante Kc bei einer Temperatur von 100 °C?
Auflösung:
Verwenden wir die Tabelle:

Tabelle zur Berechnung des Gleichgewichtskonstantenberechnungsbeispiels
Beachten Sie, dass in der Zeile, in der die Mengen, die reagieren und sich bilden, geschrieben wurden, wir wissen, dass 4 Mol N verbraucht wurden2Ö4, da das Verhältnis 1:2 ist und 8 mol NO gebildet wurden2.
Ersetzen Sie nun einfach die im Ausdruck der Gleichgewichtskonstante Kc dieser Reaktion gefundenen Werte:
Kc = [BEI DER2]2
[Nein2Ö4]
Kc = (4 mol/l) 2
(8 mol/l)
Kc = 2 mol/L
Der Wert von Kc ist dimensionslos, er hat keine Einheit bezogen auf irgendeine Größe.
Schauen wir uns nun ein Beispiel an, das auch Produkte von Anfang an enthält:
Beispiel 2: In einem geschlossenen Behälter mit einem Fassungsvermögen von 5 l befinden sich bei der Temperatur T 2 Mol Wasserstoffgas, 3 Mol Jodgas und 4 Mol Jodwasserstoff. Die Reaktion tritt bei der Temperatur T in ein chemisches Gleichgewicht ein, und es stellt sich heraus, dass sich 1 Mol Wasserstoffgas im Gefäß befindet. Wie lautet der Graph, der dieses Gleichgewicht darstellt und welchen Wert hat die Gleichgewichtskonstante Kc bei der Temperatur T?
Auflösung:
Tabelle verwenden:
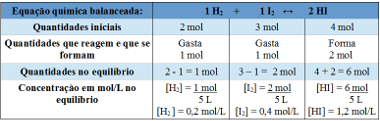
Tabelle zur Bestimmung der Gleichgewichtskonstanten
Das Diagramm, das die Variationen der Mol/L-Konzentrationen von Reagenzien und Produkten bis zum Erreichen des Gleichgewichts zeigt, kann wie folgt dargestellt werden:

Diagramm des chemischen Gleichgewichts, das Änderungen der Konzentrationen von Reagenzien und Produkten zeigt
Jetzt entdecken wir den Wert der Gleichgewichtskonstante:
Kc =__[HI]2__
[H2 ]. [ICH2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm