Ö Muscovius, Ordnungszahl 115 befindet sich in Gruppe 15 des Periodensystems und ist neben den Elementen 113, 117 und 118 eines der letzten darin enthaltenen Elemente im Jahr 2015. Sein Name ist eine Anspielung auf die Region Moskau, Russische Hauptstadt.
Moscovium wurde jedoch erstmals im Jahr 2003 durch die gemeinsame Arbeit russischer und amerikanischer Wissenschaftler hergestellt. Dennoch werden seine grundlegenden Eigenschaften fast 20 Jahre nach seiner ersten Synthese immer noch bestimmt. Daher wird viel spekuliert und über seine Eigenschaften ist wenig bekannt.
Mehr wissen: Namen der neuen chemischen Elemente – Hommagen an Städte, Regionen und Wissenschaftler
Zusammenfassung über Moscovius
Es ist ein synthetisches chemisches Element der Gruppe 15 Periodensystem.
Es wurde erstmals 2003 durch eine gemeinsame Arbeit russischer und amerikanischer Wissenschaftler synthetisiert.
Es bildet die Gruppe der Elemente, die zuletzt im Jahr 2015 in das Periodensystem aufgenommen wurden.
Ihre Studien sind sehr neu und die grundlegenden Eigenschaften werden noch bestimmt.
Seine Herstellung erfolgt durch Kernfusion 48Ca und Atome von 243Bin.
Immobilien in Moskau
Symbol: Mc
Ordnungszahl: 115
Atommasse: 288 au.m.a (nicht offiziell von Iupac)
Elektronische Konfiguration: [Rn] 7s2 5f14 6d10 19 Uhr3
Stabilstes Isotop: 288Mc (0,159 zweite Halbwertszeit)
chemische Reihe: Gruppe 15, superschwere Elemente
Moskauer Merkmale
der Muscovius ist eines der letzten enthaltenen ElementeS im Periodensystem. Die Aufnahme erfolgte am 30. Dezember 2015, der offizielle Name wurde am 8. Juni 2016 veröffentlicht.
Bis zu diesem Datum war Element 115 auf Portugiesisch als ununpentio bekannt, vom lateinischen Ununpentium, dessen Übersetzung „eins, eins, fünf“ ist. Eine weitere übernommene Nomenklatur war Eka-Wismut, was „ähnlich Wismut“ bedeutet, Element der sechsten Periode der Gruppe 15.
Der Moskauer Staat ist ein synthetisches Element, was bedeutet, dass es nur in einem Labor hergestellt werden kann. Dies ist bei superschweren Elementen sehr häufig der Fall, da sich ihr Kern mit vielen Protonen und Neutronen nicht stabilisieren kann und es daher unmöglich ist, sie in der Natur zu finden.
dafür, ein zu sein instabiles Element, unterliegen es und die anderen superschweren Elemente fast augenblicklich einem radioaktiven Zerfall – Partikelemissionen Kernelemente (wie α- oder β-Teilchen) – und die daraus resultierende Umwandlung in andere leichtere Elemente, die stabil sein können oder NEIN.
Hierzu ist anzumerken, dass die Studien noch sehr neu sind, schließlich haben wir es mit einem Element zu tun, das vor knapp 20 Jahren hergestellt wurde und dessen offizieller Status noch nicht einmal 10 Jahre alt ist. In dieser Hinsicht haben sich Wissenschaftler mehr mit der Bestimmung grundlegender Merkmale beschäftigt, wie z Atommasse und sein chemisches Verhalten in einigen möglichen Verbindungen.
Beispielsweise beträgt die wahrscheinlichste bisher nachgewiesene Atommasse für Moschus 288 Atommasseneinheiten. Ganz zu schweigen davon, dass die Beschaffung des Muscoviums sehr kompliziert ist Einkommen von nur einem Atom pro Tag.
Darüber hinaus kann das erzeugte Atom nicht immer erfasst werden, um die Masse zu messen. Im Jahr 2018 konnten Forscher der Berkeley Laboratories, Kalifornien, USA, nur eine Masse pro Woche messen. Daher, Untersuchungen über die Eigenschaften seiner Verbindungen liegen immer noch im Bereich der theoretischen Chemie, mit Berechnungen und mathematischen Modellen zur Bestimmung der erwarteten Ergebnisse.
Erhalt des Moskowy
Die Beschaffung des Moscoviums erfolgt durch Kernfusion. Ionen von 48Hier11+ (Z = 20) beschleunigte Trefferatome von 243Am (Z = 95), angeordnet in Form von AmO2 auf einem kreisförmigen Ziel Titan von 32 cm², wodurch das Moscovium (Z = 115) und drei Neutronen entstehen.
Nach dem Aufprall, in etwa einer Mikrosekunde (10-6 Zweitens trifft das Muskovy-Atom auf den Detektor, der etwa vier Meter von der Kollisionsstelle entfernt ist. Auf diesem Weg durchläuft das Element auch einen Abscheider, sodass leichtere Reaktionsprodukte abgezweigt werden. Im Detektor das Muscovium wird anhand seines radioaktiven Zerfallsmusters erkannt.
Moscovium durchläuft als radioaktives Atom einen Alpha-Zerfall (ein radioaktives Teilchen mit zwei Protonen und zwei Neutronen) und erzeugt dabei Element 113 (Nihonium, Nh) bis Element 105 (Dubnium, Db). Schließlich verwandelt sich der Db in den Rutherfordium (Rf), das sich schnell in zwei Fragmente aufspaltet. Das Zerfallsmuster von Moscovium ist unten dargestellt.
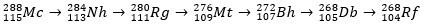
Geschichte Moskaus
der Muscovius war erstmals 2003 synthetisiert, zwischen dem 14. Juli und 10. August, durch die gemeinsame Arbeit von Wissenschaftlern des Gemeinsamen Instituts für Kernforschung in Dubna, Russland, und das Lawrence Livermore National Laboratory in Livermore, Kalifornien.
Ionen von 48Ca, damit sie mit Atomen von kollidieren könnten 243Ich produziere zunächst das Isotop 291Mc. Dabei wurde der Kern auf unglaubliche 4 x 10 erhitzt11 K, und dann durch die sehr schnelle Emission von drei Neutronen und Gammastrahlen abgekühlt.

Durch diese Aktion entstand das Isotop 288Mc. dann der Moscovius wurde anhand seines radioaktiven Zerfallsmusters entdeckt und analysiert (Alpha-Zerfälle). Der Name Moskau ist eine Hommage an die Region Moskau, Russland.
Lesen Sie auch:Seaborgium – das synthetische chemische Element, benannt nach dem Wissenschaftler Glenn Seaborg
Übungen zum Muscovius gelöst
Frage 1
Moscovium, ein kürzlich entdecktes Element, wurde in Gruppe 15 des Periodensystems eingeordnet. Basierend auf den anderen Elementen in dieser Gruppe wäre das erwartete Hydrid für dieses Element:
A) McH
B) McH2
C) McH3
D) McH4
E) Mc2H3
Auflösung:
Alternative C
Andere Elemente der Gruppe 15, wie z Stickstoff Es ist Phosphor, präsentieren Sie die Formeln NH3 und pH-Wert3 wenn es an Wasserstoff gebunden ist. Daher wird erwartet, dass das Moscovium die Formel McH aufweist3 Auch.
Frage 2
Im Jahr 2003 wurde Moscovium (Z = 115) durch die gemeinsame Arbeit russischer und amerikanischer Wissenschaftler erstmals synthetisiert. Damals das Isotop 288Mc wurde entdeckt und seine Produktion war unerlässlich, um dieses Element in das Periodensystem aufzunehmen. Die Anzahl der Neutronen in diesem Isotop beträgt:
A) 115
B) 288
C) 403
D) 173
E) 170
Auflösung:
Alternative D
Die Anzahl der Neutronen lässt sich so berechnen:
A = Z + n
Dabei ist A die Massenzahl, Z die Ordnungszahl und n die Anzahl der Neutronen. Wenn wir die Werte ersetzen, erhalten wir:
288 = 115 + n
n = 288 – 115
n = 173
Von Stefano Araujo Novais
Chemielehrer

