Kp ist das Akronym zur Bestimmung der Konstante eines Gleichgewichts in Bezug auf die Partialdrücke. Diese Konstante arbeitet beispielsweise mit den Werten der gasförmigen Teilnehmer eines Gleichgewichts in der atm-Einheit.

Gleichung, die eine chemische Reaktion mit gasförmigen Komponenten darstellt
In dieser Gleichung sind alle Teilnehmer gasförmig, wenn also ein beteiligtes Gas a Partialdruck im Gemisch, es wird durch die Abkürzung pX dargestellt.
Bei der Aufstellung der chemischen Gleichgewichtsgleichung (in Bezug auf die Konzentration) müssen die Produkte in den Zähler und die Edukte in den Nenner gestellt werden:
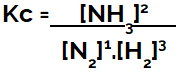
Kc Ausdruck des Ammoniakbildungsgleichgewichts
der Ausdruck von Gleichgewichtskonstante in Bezug auf den Druck (Kp) folgt dem Muster von Kc, d. h. die Partialdrücke der Reagenzien stehen im Nenner und die Partialdrücke der Produkte im Zähler:
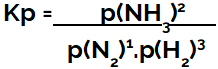
Kp Ausdruck des Ammoniakbildungsgleichgewichts
Überwachung: Wenn die Reaktionsgleichung der chemisches Gleichgewicht keinen gasförmigen Teilnehmer präsentieren, wird er nicht automatisch präsentieren Kp.
Beispiel: (PUC-MG) Für die Reaktion: 2 CO(g) + Aus2(g)? 2 CO2(g), die Partialdrücke von CO(g) es ist das2(g) im Gleichgewicht betragen sie 0,2 atm bzw. 0,4 atm. Der Gesamtsystemdruck beträgt 1,4 atm. Der Wert von Kp für die Reaktion ist:
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
Die von der Übung bereitgestellten Daten sind:
Kohlenmonoxid-Partialdruck (pCO) = 0,2 atm;
Partialdruck von Kohlenmonoxid (pO2) = 0,4 atm;
Gesamtdruck = 1,4 atm;
Um den Kp dieses Systems zu bestimmen, müssen wir die folgenden Schritte ausführen:
1. Schritt: Bestimmen Sie den Partialdruck von Kohlenmonoxid (pCO2).
Denken Sie dabei daran, dass der Gesamtdruck (pt) die Summe aller Partialdrücke ist:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. Schritt: Bestimmen Sie den Kp der Übung.
Verwenden Sie dazu einfach die Werte im Ausdruck der Gleichgewichtskonstante Kp:
Kp = (pCO2)2
(pCO)2.(Staub2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Von mir. Diogo Lopes Dias
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
TAGE, Diogo Lopes. "Was ist Kp?"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm. Zugriff am 27. Juli 2021.