wird genannt Rutherford-Modell den Vorschlag des Wissenschaftlers Ernest Rutherford für das Atom von 1911 mit dem Ziel, die idealisierte Form und Zusammensetzung des Bestandteils der Materie zu demonstrieren: Atom.
Ö Rutherford-Modell es ist allgemein als das Modell des Sonnensystems bekannt, da seine Struktur und Funktionsweise mit der Beziehung zwischen der Sonne und den um sie kreisenden Planeten verglichen wurden.
Rutherford verglich in seinem Modell die Sonne mit dem Atomkern und die Elektronen des Atoms mit den Planeten des Sonnensystems, wie in der folgenden Darstellung zu sehen ist:
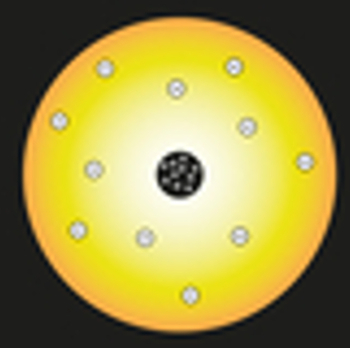
Darstellung des Rutherford-Atommodells
Im Kern würden sich positiv geladene Teilchen, Protonen genannt (entdeckt von Eugen Goldstein), befinden. Dieser Kern wäre klein und dicht und hätte die größte Masse des Atoms.
Das Experiment von Rutherford
Alle Vorschläge Rutherfords zur Erstellung seines Atommodells waren das Ergebnis eines Experiments, bei dem er Alphastrahlen (abstammend von aus radioaktivem Polonium in einer Bleidose) auf einer dünnen Goldplatte, mit einer Metallplatte, die hinten und an den Seiten mit Zinksulfid bedeckt ist. Seiten. Zinksulfid ist ein Salz, das bei Strahlung glänzt.
Rutherford stellte dann fest, dass während dieses Experiments insbesondere drei Punkte (a, b, c) leuchteten:
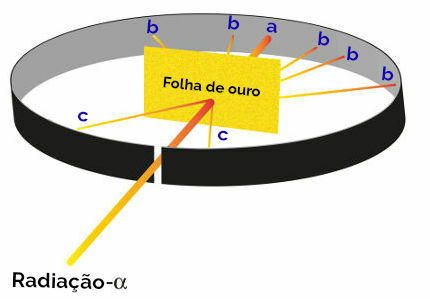
Darstellung des Rutherford-Experiments
Punkt a (höherer Lichteinfall): zeigte an, dass die Alphastrahlung die Goldplatte problemlos durchquerte, da sie in Richtung des Öffnungslochs des Bleiblocks wäre;
Punkt b (geringes Glühen): zeigt an, dass die Alphastrahlung die Goldplatte durchquert hat, aber während der Durchquerung abgewichen wäre;
Punkt c (eine extrem kleine Menge an Glühen): vor der goldenen Klinge gelegen, zeigte an, dass keine Alphastrahlung durchgelassen wurde.
Rutherford führte diese beobachteten Ergebnisse den Atomen zu, die die Goldplatte bilden, und interpretierte sie wie folgt:
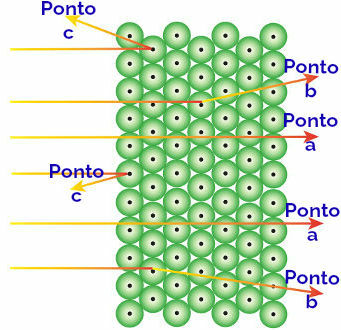
Darstellung des Verhaltens von Alphastrahlung und Atomen
Alphastrahlung erreicht die zeigen auf: Alphastrahlung ist positiv und durchdringt einen Bereich des Atoms mit riesigen leeren Räumen. In einigen Orbitalen sind auch Elektronen vorhanden.
Alphastrahlung erreicht die Punkt b: Die Alphastrahlung durchdringt die Atome der Goldplatte, erreicht aber einen bestimmten Zeitpunkt, wenn Es passiert nahe dem kleinen Kern des Atoms, der positiv geladen ist, und erzeugt eine Abstoßung im Strahlung.
Alphastrahlung erreicht die Punkt c: Die Alphastrahlung durchdringt die Atome der Goldplatte, trifft aber auf einen kleinen Kern, der positiv geladen ist, wodurch die Strahlung abgestoßen wird.
Problematik des Rutherford-Modells
Viele Physiker wiesen auf einige Probleme des von Rutherford vorgeschlagenen Modells hin:
1. Problem: Wie wäre ein positiv geladener Kern möglich, wenn sich positiv geladene Teilchen gegenseitig abstoßen?
2. Problem: Warum werden Elektronen in Elektrosphären nicht von Protonen im Kern angezogen?
3. Problem: Warum verlieren Elektronen, die kleine Körper in ständiger Bewegung sind, nicht Energie und fallen in den Kern?
* Bildnachweis: Svic / Shutterstock
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm