Reaktionen mit basische Oxide sind chemische Phänomene, bei denen ein Stoff dieser Oxidklasse in den gleichen Behälter wie a anorganische Säure, ein Säureoxid oder eins amphoteres Oxid.
Auch sehen:Reaktionen mit amphoteren Oxiden
anorganisches Salz und Wasser sind gängige Produkte in a Reaktion mit basischen Oxiden. Um herauszufinden, ob anorganisches Salz oder Wasser produziert wird, müssen wir uns die Begleitsubstanz des basischen Oxids im Reagenz ansehen. Sehen Sie sich die Beispiele unten an und verstehen Sie, wie dieser Prozess abläuft.
Reaktionen mit basischen Oxiden und anorganischen Säuren
Bei Reaktionen zwischen basischen Oxiden und anorganischen Säuren entsteht ein anorganisches Salz und Wasser, da das basische Oxidkation (Y+) wechselwirkt mit dem Anion (X-) der Säure und das Hydronium-Kation (H+) der Säure wechselwirkt mit dem Anion des Oxids:
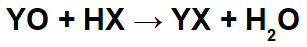
Beispiel: Radiumoxid und Bromwasserstoffsäure
Bei dieser Reaktion haben wir Radiumoxid (RaO) und Bromwasserstoffsäure (Hbr) als Reaktionspartner. Somit treten folgende Wechselwirkungen auf:
Radiokation (Ra+2) mit dem Bromidanion (Br-1) bildet das Radiumbromidsalz (RaBr2).
Hydroniumkation (H+1) mit dem Oxidanion (O-2) bildendes Wasser (H2Ö).
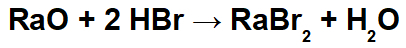
Auch sehen:Reaktionen mit Doppeloxiden
Reaktionen mit basischen Oxiden und sauren Oxiden
Bei diesen Reaktionen wird durch die Wechselwirkung zwischen dem basischen Oxidkation (Y+) und das resultierende Säureanion (WODie-) der chemischen Reaktion zwischen einem Säureoxid und Wasser.
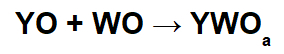
Beispiel: Natriumoxid und Schwefeldioxid
Bei dieser Reaktion haben wir Natriumoxid (Na2O) und Schwefeldioxid (SO2). Bemerkenswert ist, dass bei der Wechselwirkung des Säureoxids mit Wasser zunächst schweflige Säure (H2NUR3):

Aus der Bildung dieser Säure wird die Wechselwirkung zwischen dem Natriumkation (Na+1) des basischen Oxids und des Sulfit-Anions (SO3-2) der Säure unter Bildung des Natriumsulfitsalzes (Na2NUR3):
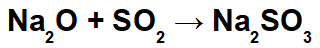
Reaktionen mit basischen Oxiden und amphoteren Oxiden
Amphotere Oxide sind Stoffe, die ein zweifaches chemisches Verhalten aufweisen: In Gegenwart einer sauren Substanz verhält es sich wie ein basisches Oxid; in Gegenwart eines basischen Stoffes verhält es sich wie ein Säureoxid.
Also wenn a basisches Oxid reagiert mit einem amphoteren Oxid, verhält sich dieses wie ein Säureoxid und bildet in Gegenwart von Wasser eine anorganische Säure. Die Reaktion zwischen dem Anion der anorganischen Säure und dem Kation des basischen Oxids bildet ein Salzprodukt.
Beispiel: Kaliumoxid und Chrom-III-oxid
Bei dieser Reaktion haben wir Kaliumoxid als Reaktanten (K2O) und Chromoxid (Cr2Ö3). Es ist bemerkenswert, dass bei der Wechselwirkung von amphoterem Oxid mit Wasser zunächst die Bildung von Chromosomensäure (2HCrO2):

Aus der Bildung dieser Säure entsteht die Wechselwirkung zwischen dem Kaliumkation (K+1) des basischen Oxids und des Chromitanions (SO3-2) der Säure unter Bildung des Kaliumchromitsalzes (2KCrO2):

Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm
