Kps ist das Akronym, das verwendet wird, um die Löslichkeitsproduktkonstante, die sich auf das Produkt (Multiplikation) von bezieht Konzentrationen in der Stoffmenge der in einer Lösung vorhandenen Ionen.
Wenn einem Lösungsmittel wie Bariumsulfat ein schwer löslicher gelöster Stoff zugesetzt wird, wird eine kleine Menge Ein Teil dieses Salzes löst sich im Wasser auf, der Rest sammelt sich am Boden des Behälters und bildet den Körper von Hintergrund. Das sich auflösende Salz leidet Dissoziation, wobei Kationen und Anionen ins Wasser abgegeben werden.

Niederschlag in einer Lösung mit Wasser und Bariumsulfat vorhanden
Außerdem präsentiert sich das Salz nicht gut Löslichkeit, ändert sich die Menge des gelösten Stoffes im Laufe der Zeit nicht, da ein Auflösungsgleichgewicht zwischen den Salzionen (in der Lösung vorhanden) und dem Hintergrundkörper besteht.

BaSO-Auflösungsbilanz4 im Wasser
Kps eines gelösten Stoffes
Ö Kps eines gelösten Stoffes ist das Produkt der molaren Konzentrationen der beteiligten Ionen. Es ist immer erforderlich, die Ionenkonzentration auf ihren jeweiligen stöchiometrischen Koeffizienten (zum Ausgleich der Gleichung) zu erhöhen.

Auflösungsgleichgewicht des Elektrolyten YDasXB
Ö Kps des vorgeschlagenen Gleichgewichts für Salz YDasXB es wird die Konzentration des Reagens Y (angehoben auf seinen stöchiometrischen Koeffizienten (a) und die Konzentration des Produkts X (angehoben auf seinen stöchiometrischen Koeffizienten (b)) aufweisen.
Kps = [Y+b]Das.[X-Das]B
Beispiel
Angenommen, wir bereiten eine Lösung mit Wasser und Aluminiumcyanid [Al(CN)3], ein praktisch unlösliches Salz in Wasser. Wenn dieses Salz zu Wasser hinzugefügt wird, erleidet es am Ende das Phänomen der Dissoziation.

Al (CN) Elektrolyt-Auflösungsgleichgewicht3
Durch die Gleichung des Gleichgewichts der Salzauflösung haben wir also, dass es Kps hat die Multiplikation der Konzentration des Aluminiumkations (Al+3) erhöht auf den Exponenten 1 durch die Konzentration des Cyanidanions (CN-1) auf Exponent 3 erhöht.
Kps = [Al+3]1.[CN-1]3
Kps Bedeutungen eines gelösten Stoffes
Wenn wir die finden Kps eines bestimmten mit Wasser vermischten Salzes kennen wir auch die Konzentration jedes der Ionen in der Lösung. Mit diesen Daten können wir die Rangfolge einer Lösung oder das Verhalten des gelösten Stoffes in der Lösung bestimmen. Betrachten Sie die folgende Bilanz:

Auflösungsgleichgewicht des Elektrolyten YDasXB
Wir können folgende Beziehungen herstellen:
Wenn Kps = [Y+b]Das.[X-Das]B = 0, wir haben eine gesättigte Lösung ohne Präzipitat;
Wenn Kps > [Y+b]Das.[X-Das]B = 0, haben wir eine ungesättigte Lösung, d. h. eine geringe Menge gelöster Stoffe im Lösungsmittel (im Verhältnis zu Löslichkeitskoeffizient);
Wenn Kps < [Y+b]Das.[X-Das]B = 0, wir haben eine gesättigte Lösung mit einem Bodenkörper, dh es kommt zu einer Ausfällung des Elektrolyten (gelöster Stoff);
Wenn der Kps-Wert des Elektrolyten zu niedrig ist, handelt es sich um ein schwer lösliches Material im Lösungsmittel.
Beispiel von Kps-Berechnung eines gelösten Stoffes
(UERN): Die Löslichkeit von Calciumnitrat [Ca (NO3)2] in Wasser ist 2,0. 10–3 mol/Liter bei einer bestimmten Temperatur. Die Kps dieses Salzes bei der gleichen Temperatur sind:
a) 8.10–8.
b) 8,10–10.
c) 3.2.10–10
d) 3.2.10–8
Übungsdaten:
Salzformel: Ca (NO3)2;
Molare Salzkonzentration (Löslichkeit): 2,0. 10–3 mol/l.
Um Kps zu lösen und zu berechnen, müssen Sie Folgendes tun:
Schritt 1: Stellen Sie die Salzauflösungswaage ein.
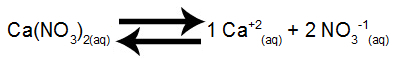
Auflösungsgleichgewicht von Calciumnitrat in Wasser
Calciumnitrat setzt bei der Dissoziation in Wasser 1 mol Calciumkationen (Ca+2) und 2 mol Nitrat-Anionen (NO3-1).
Schritt 2: Stellen Sie den Ausdruck der Kps des Salzes zusammen
Die Kps dieses Salzes sind das Produkt der auf Exponent 1 angehobenen Calciumkationenkonzentration durch die auf Exponent 2 angehobene Konzentration des Nitrat-Anions, wie unten gezeigt:
Kps = [Ca+2]1.[BEI DER3-1]2
Schritt 3: Bestimmen Sie die Werte der Ionenkonzentrationen in der Lösung
Um die Kps zu berechnen, benötigen wir die Werte der Ionenkonzentrationen, die Übung liefert jedoch die Molarität des Salzes in der Lösung. Um die Konzentration jedes Ions zu bestimmen, multiplizieren Sie einfach die Molarität des Salzes mit dem stöchiometrischen Koeffizienten des Reaktionsteilnehmers:
Für Calciumkation:
[Hier+2] = 1. 2,0. 10–3
[Hier+2] = 2,0. 10–3 mol/L
Für das Nitrat-Anion:
[BEI DER3-1] = 2. 2,0. 10–3
[BEI DER3-1] = 4,0. 10–3 mol/L
Schritt 4: Verwenden Sie die in Schritt 3 gefundenen Konzentrationswerte im Kps-Ausdruck (bestimmt in Schritt 2).
Kps = [Ca+2]1.[BEI DER3-1]2
Kps = [2,10-3]1.[4.10-3]2
Kps = 2,10-3.16.10-6
Kps = 32,10-9
oder
Kps = 3.2.10-9 (mo/m)
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm
