Nitrierungsreaktionen sind Substitutionsreaktionen, die durch Salpetersäure (HNO3). Diese Art der Reaktion tritt insbesondere bei Alkanen und bei Benzol und seinen Derivaten auf, bei denen eines der an der Kette oder am aromatischen Kern gebundenen Wasserstoffatome durch die NO-Gruppe ersetzt wird.2, was zu einer Nitroverbindung und Wasser führt.
Sehen Sie einige Beispiele:
1. Nitrierung eines Alkans:
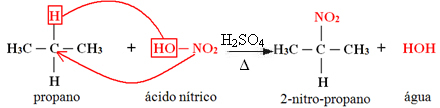
Wenn das Alkan mehr als zwei Kohlenstoffatome hat, wird ein Gemisch unterschiedlicher substituierter Verbindungen gebildet. Die Menge jeder erhaltenen Verbindung ist proportional zu der folgenden Leichtigkeit, mit der Wasserstoff in das Molekül freigesetzt wird:

Im obigen Fall gibt es keinen tertiären Kohlenstoff, es gibt nur einen sekundären und zwei primäre; daher wird die größte Menge an als Produkt gebildeter Verbindung 2-Nitropropan sein.
Bei ausreichender Salpetersäure kann ein anderer Wasserstoff durch die Nitrogruppe ersetzt werden, wodurch 2-Dinitropropan entsteht (Struktur unten), eine Verbindung, die häufig als Additiv zu Dieselöl verwendet wird, die Oktanzahl erhöht und die Emission von Ruß.
BEI DER2
│
H3C─C─CH3
│
BEI DER2
2. Benzolnitrierung:
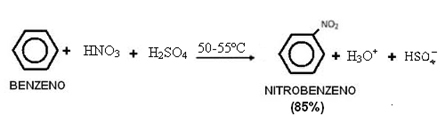
Beachten Sie, dass diese Reaktion in Gegenwart von Wärme abläuft, da das Benzol mit einem schwefelhaltigen Gemisch erhitzt wird, dh konzentrierter Salpetersäure mit konzentrierter Schwefelsäure. Schwefelsäure ist ein Katalysator, der die Reaktionsgeschwindigkeit erhöht, da Benzol langsam mit Salpetersäure reagiert.
3. Nitrierung von Benzolderivaten:
In solchen Fällen hängt der Substitutionsort von der Substituentengruppe oder funktionellen Gruppe ab, die an den aromatischen Kern gebunden ist. Die Texte"Lenkungsradikale im Benzolring" und "Elektronische Effekte von meta- und ortho-to-directors-Radikalen“ erklären Sie mehr darüber, wie dies geschieht.
Aromatische Ringe können nitrieren und zu Sprengstoffen führen. Ein Beispiel ist Trinitrotoluol (2-Methyl-1,3,5-trinitrobenzol), besser bekannt als TNT, und es gibt mehrere Pigmente, die hauptsächlich in Stoffen verwendet werden.
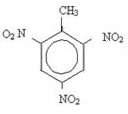
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/reacoes-organicas-nitracao.htm

