*Theorie von Arrhenius:
Basierend auf seinen Experimenten zur elektrischen Leitfähigkeit in wässrigen Medien wurden die chemischen, physikalischen und mathematischen Der Schwede Svante August Arrhenius (1859-1927) schlug 1884 die folgenden Konzepte vor, um Säuren zu definieren und Basen:

Allgemein haben wir also:
H+ + H2O → H3Ö+
Beispiele:
HCl + H2O → H3Ö++ Cl-
HNO3+ H2O → H3Ö+ + NEIN3-
H2NUR4+ 2H2O → 2H3Ö+ + Betriebssystem42-

Beispiele:
NaOH → Na + + OH-
Ca(OH)2 →Ca2+ + 2 OH-
*Brönsted-Lowry-Theorie:
Unabhängig davon der Däne Johannes Nicolaus Brönsted (1879-1947) und der Engländer Thomas Martin Lowry (1874-1936), schlug im selben Jahr eine andere Säure-Basen-Theorie vor, die als Brönsted-Lowry-Theorie bekannt ist, die besagt, dass Folgendes:

In diesem Fall wird das Wasserstoffion als Proton betrachtet. Dies zeigt sich in der folgenden Reaktion, bei der Blausäure ein Proton an Wasser abgibt, das somit als Base fungiert:
HCN + H2O → CN- + H3Ö+
Diese Reaktion ist reversibel, wobei das Hydroniumion (H
3Ö+) kann ein Proton an das CN-Ion abgeben-. Somit ist das Hydronium-Ion (H3Ö+) wirkt als Säure und das CN- als Basis.CN- + H3Ö+→ HCN + H2Ö
*Lewis-Theorie:
Diese Theorie wurde von dem amerikanischen Chemiker Gilbert Newton Lewis (1875-1946) erstellt und sagt Folgendes:

Diese Theorie führt ein neues Konzept ein, ist umfassender, entkräftet jedoch nicht die Brönsted-Lowry-Theorie. Denn jede Lewis-Säure ist eine Brönsted-Säure, und daher ist jede Lewis-Base eine Brönsted-Base. Dies liegt daran, dass ein Proton Elektronen erhält, was bedeutet, dass sich eine Lewis-Säure mit einem einsamen Elektronenpaar in einer Lewis-Base verbinden kann.
Für Lewis besteht eine Säure-Base-Reaktion in der Bildung einer stabileren koordinierten kovalenten Bindung. Wenn also eine Lewis-Base ein Elektronenpaar an eine Lewis-Base abgibt, bilden beide a koordinative kovalente Bindung, bei der beide Elektronen von einem der Atome stammen, wie im Beispiel unten:
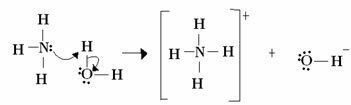
Ammoniak fungiert in diesem Fall als Lewis- und Brönsted-Base, da es seine beiden Elektronen an das Proton abgibt und somit Empfänger des Protons ist. Außerdem wurde eine kovalente Bindung zwischen Wasserstoff (dem Proton) und Ammoniak gebildet.
Wasser ist Lewis-Säure und Brönsted-Säure, da es das Proton spendet und Elektronen aufnimmt. Beachten Sie, dass der Sauerstoff in dem aus Wasser gebildeten Hydroxid ein zusätzliches Elektronenpaar hat.

Von Jennifer Fogaça
Abschluss in Chemie
Schulteam Brasilien.
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm