Das chemische Gleichgewicht ist eines der Themen, die in Enem- und Aufnahmeprüfungen am häufigsten fallen.
In den Fragen werden Aspekte reversibler Reaktionen angesprochen und die Kandidaten sowohl rechnerisch als auch konzeptionell bewertet.
Vor diesem Hintergrund haben wir diese Liste von Fragen mit verschiedenen Ansätzen zum chemischen Gleichgewicht erstellt.
Nutzen Sie die Lösungskommentare, um sich auf die Prüfungen vorzubereiten, und lesen Sie die Schritt-für-Schritt-Anleitungen zum Lösen der Fragen.
Allgemeine Konzepte des chemischen Gleichgewichts
1. (Uema) In der Gleichung , nach Erreichen des chemischen Gleichgewichts können wir auf die Gleichgewichtskonstante schließen
, über die man richtigerweise sagen kann:
a) Je höher der Wert von Kc, desto geringer die Ausbeute der direkten Reaktion.
b) Kç unabhängig von der Temperatur.
c) Wenn die Geschwindigkeiten der Hin- und Rückreaktion gleich sind, dann ist Kc = 0.
d) Kç sie hängt von den anfänglichen Molaritäten der Reaktanten ab.
e) je höher der Wert von Kc, desto höher die Konzentration der Produkte.
Richtige Antwort: e) Je höher der Wert von Kc, desto höher die Konzentration der Produkte.
Die direkte Reaktion wird durch die Zahl 1 dargestellt, wobei:
Die Umkehrreaktion wird dargestellt durch
Der Wert von Kç sie wird aus dem Verhältnis zwischen den Konzentrationen von Produkten und Reagenzien berechnet.
Der Zähler (der die Produkte enthält) ist direkt proportional zur Gleichgewichtskonstante. Je höher daher der Wert von Kç, desto höher ist die Ausbeute der direkten Reaktion, je mehr Produkt gebildet wird und desto höher die Konzentration der Produkte.
Der Wert von Kç variiert mit der Temperatur, denn wenn wir seinen Wert ändern, kann die endotherme (Wärmeaufnahme) oder exotherme (Wärmeabgabe) Reaktion sein begünstigt und damit kann mehr Reagenz oder Produkt verbraucht oder erzeugt werden, wodurch sich die Gleichgewichtskonstante ändert, die von der Konzentration von. abhängt Reagenzien.
Kc hängt von den molaren Mengen der Komponenten ab, wenn sich ein Gleichgewicht einstellt und wenn die Geschwindigkeiten der Hin- und Rückreaktion gleich sind.
2. (UFRN) Das chemische Gleichgewicht zeichnet sich dadurch aus, dass es auf mikroskopischer Ebene dynamisch ist. Um quantitative Informationen über das Ausmaß des chemischen Gleichgewichts zu erhalten, wird die Gleichgewichtskonstante verwendet. Betrachten Sie den folgenden Streifen:

Auf das chemische Gleichgewicht angewendet, die Idee des Gleichgewichts des Charakters:
a) Es ist richtig, weil im chemischen Gleichgewicht immer die Hälfte der Mengen Produkte und die andere Hälfte Reaktanten sind.
b) Es ist nicht richtig, da im chemischen Gleichgewicht die Konzentrationen von Produkten und denen von Edukten unterschiedlich sein können, aber konstant sind.
c) Es ist richtig, weil im chemischen Gleichgewicht die Konzentrationen von Edukten und Produkten immer gleich sind, solange das Gleichgewicht nicht durch eine äußere Einwirkung gestört wird.
d) Es ist nicht richtig, da im chemischen Gleichgewicht die Konzentrationen der Produkte immer höher sind als die der Reaktionspartner, solange das Gleichgewicht nicht durch einen äußeren Faktor beeinflusst wird.
e) Es ist richtig, weil im chemischen Gleichgewicht die Konzentrationen von Edukten und Produkten nicht immer gleich sind.
Richtige Antwort: b) Das ist nicht richtig, da im chemischen Gleichgewicht die Konzentrationen von Produkten und denen von Reaktionspartnern unterschiedlich sein können, aber konstant sind.
Im Gleichgewicht können die Produkt- und Reagenzienmengen anhand der Konstanten von. berechnet werden Gleichgewicht, und sollte nicht unbedingt die Hälfte der Produktmenge und die andere Hälfte betragen Reagenzien.
Gleichgewichtskonzentrationen sind nicht immer gleich, sie können unterschiedlich sein, aber konstant, wenn keine Gleichgewichtsstörungen auftreten.
Die Gleichgewichtskonzentrationen müssen davon abhängen, welche Reaktion begünstigt wird, sei es direkt oder invers. Wir können dies durch den Wert von K. wissenç: wenn Kç 1, Direkte Reaktion wird bevorzugt. schon wenn Kç
1 wird die Rückreaktion begünstigt.
Chemische Bilanzdiagramme
3. (UFPE) Zu Beginn des 20. Jahrhunderts erzeugte die Erwartung des Ersten Weltkriegs einen großen Bedarf an Stickstoffverbindungen. Haber war Pionier bei der Herstellung von Ammoniak aus Stickstoff in der Luft. Wird Ammoniak in einen geschlossenen Behälter gefüllt, zersetzt es sich nach folgender unausgeglichener chemischer Gleichung: NH3(G) → N2(g) + H2(g). Die zeitlichen Schwankungen der Konzentrationen sind in der folgenden Abbildung dargestellt:

Aus der Analyse der obigen Abbildung können wir feststellen, dass die Kurven A, B und C die zeitliche Änderung der Konzentrationen der folgenden Reaktionskomponenten darstellen:
a) H2, Nein2 und NH3
b) NH3, H2 und nein2
c) NH3, Nein2 und H2
d) Nein2, H2 und NH3
e) H2, NH3 und nein2
Richtige Antwort: d) N2, H2 und NH3.
1. Schritt: Gleichgewicht der chemischen Gleichung.
2 NH3(G) → N2(g) + 3 H2(g)
Bei der ausgewogenen Reaktion haben wir festgestellt, dass 2 Mol Ammoniak benötigt werden, um sich in Stickstoff und Wasserstoff zu zersetzen. Außerdem ist die bei der Reaktion erzeugte Wasserstoffmenge dreimal größer als die von Ammoniak.
2. Schritt: Chartdaten interpretieren.
Wenn Ammoniak zersetzt wird, ist seine Konzentration im Diagramm maximal und nimmt ab, wie in Kurve C zu sehen ist.
Die Produkte, wie sie gebildet werden, sind zu Beginn der Reaktion die Konzentrationen Null und nehmen zu, wenn der Reaktant ein Produkt wird.
Da die produzierte Wasserstoffmenge dreimal größer ist als die von Stickstoff, ist die Kurve für dieses Gas am größten, wie in B angegeben.
Das andere gebildete Produkt ist Stickstoff, wie in Kurve A zu sehen ist.
4. (Cesgranrio) Das durch die Gleichung dargestellte System war im Gleichgewicht. Durch Zugabe der Substanz G wurde der Gleichgewichtszustand schlagartig verändert. Das System reagiert, um das Gleichgewicht wiederherzustellen. Welches der folgenden Diagramme repräsentiert am besten die Veränderungen, die während des beschriebenen Prozesses aufgetreten sind?
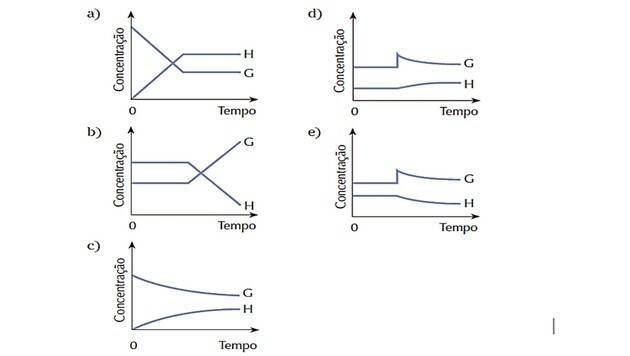
Richtige Antwort: d).

Da sich das System zu Beginn im Gleichgewicht befand, blieben die Mengen der Stoffe G und H konstant.
Die Störung trat auf, als die Konzentration von G zunahm und das System reagierte, indem es dieses umwandelte Reaktant in mehr Produkt H, was das Gleichgewicht nach rechts verschiebt, d. h. die Reaktion begünstigt Direkte.
Wir beobachten, dass die Reagenskurve G mit dem Verbrauch abnimmt und die Produktkurve H mit der Bildung ansteigt.
Wenn sich ein neues Gleichgewicht einstellt, werden die Mengen wieder konstant.
Gleichgewichtskonstante: Zusammenhang zwischen Konzentration und Druck
5. (UFRN) Zu wissen, dass KP = Kç (RT)nein, können wir sagen, dass KP = Kç, zum:
Stahl2(G) + H2(g) ↔ CO(G) + H2Ö(G)
b) H2(g) + ½ der2(g) H2Ö(1)
c) Nein2(g) + 3 H2(g) ↔ 2 NH3(G)
d) NEIN(G) + ½ O2(G) ↔ NEIN2(G)
e) 4 FeS(s) + 7 O2(g) ↔ 2 Fe2Ö3(s) + 4 SO2(G)
Richtige Antwort: a) CO2(G) + H2(g) ↔ CO(G) + H2Ö(G)
Nach KP gleich K. seinç die Schwankung der Molzahl muss gleich Null sein, da jede auf Null angehobene Zahl zu 1 führt:
KP = Kç (RT)0
KP = Kç x 1
KP = Kç
Die Änderung der Molzahl wird berechnet durch:
∆n = Molzahl der Produkte - Molzahl der Reagenzien
In diese Berechnung gehen nur die Koeffizienten von Stoffen im gasförmigen Zustand ein.
Auf jede alternative Gleichung anwendend haben wir:
| Stahl2(G) + H2(g) ↔ CO(G) + H2Ö(G) | n = [(1+1) - (1+1)] = 2 - 2 = 0 |
| b) H2(g) + ½ der2(g) H2Ö(1) | n = [0 - (1+1/2)] = 0 - 3/2 = - 3/2 |
| c) Nein2(g) + 3 H2(g) ↔ 2 NH3(g) | n = [2 - (1+3)] = 2 - 4 = - 2 |
| d) NEIN(G) + ½ der2(g) ↔ NEIN2(g) | n = [1 - (1+1/2)] = 1 - 3/2 = - 1/2 |
| e) 4 FeS(s) + 7 O2(g) ↔ 2 Fe2Ö3(s) + 4 SO2(g) | n = [(0+4) - (0+7)] = 4 - 7 = - 3 |
Mit diesen Ergebnissen können wir beobachten, dass die Alternative, deren Wert dem geforderten Ergebnis entspricht, diejenige in der ersten Gleichung ist.
6. (UEL-adaptiert) Für die Reaktion dargestellt durch die Gleichgewichtskonstanten Kç und KP werden durch die Gleichungen ausgedrückt: (Gegeben: p = Partialdruck)
Richtige Alternative:
Die Gleichgewichtskonstante wird berechnet durch:
Feste Verbindungen nehmen aufgrund ihrer konstanten Konzentrationen nicht an der Berechnung von K. teilç, daher ist die Gleichgewichtskonstante für die gegebene Gleichung:
Für die Gleichgewichtskonstante in Bezug auf den Druck nehmen nur die Gase an der Berechnung teil, also:
Berechnung der Gleichgewichtskonstanten
7. (Enem/2015) Mehrere Säuren werden in Industrien eingesetzt, die ihre Abwässer in Gewässer wie Flüsse und Seen entsorgen, was die Umweltbilanz beeinträchtigen kann. Um den Säuregehalt zu neutralisieren, kann dem Abwasser in geeigneten Mengen Calciumcarbonatsalz zugesetzt werden, da es Bicarbonat produziert, das das Wasser neutralisiert. Die am Prozess beteiligten Gleichungen werden dargestellt:
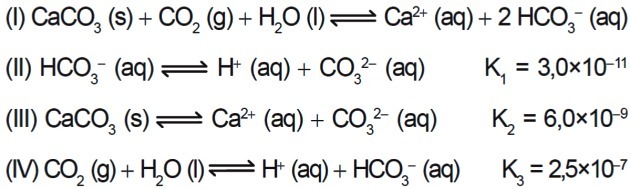
Welchen Zahlenwert hat die Gleichgewichtskonstante der Reaktion I basierend auf den Werten der Gleichgewichtskonstanten der Reaktionen II, III und IV bei 25°C?
a) 4,5 x 10-26
b) 5,0 x 10-5
c) 0,8 x 10-9
d) 0,2 x 105
e) 2,2 x 1026
Richtige Antwort: b) 5,0 x 10-5
1. Schritt: Nehmen Sie die notwendigen Anpassungen mit dem Hessschen Gesetz vor.
Gegeben eine chemische Gleichung:
Die Konstante wird berechnet durch:
Aber wenn wir die Gleichung umkehren, erhalten wir als Ergebnis:
Und die Konstante wird zur Umkehrung:
Um zu der in der Frage angegebenen Gleichung 1 zu gelangen, müssen wir die Gleichung II wie im vorherigen Beispiel invertieren.
2. Schritt: Manipulieren Sie die Gleichungen II, III und IV, um zum Ergebnis von Gleichung I zu gelangen.
3. Schritt: Berechnen Sie die Gleichgewichtskonstante von Gleichung I.
Berechnung von Kich erfolgt durch Multiplikation der konstanten Werte.
Da wir in der Berechnung gleiche Potenzen der Basen haben, wiederholen wir die Basis und addieren die Exponenten.
Da wir nun eine Division mit gleichen Potenzen der Basen haben, wiederholen wir die Basis und subtrahieren die Exponenten.
8. (UnB) Phosphorpentachlorid ist ein sehr wichtiges Reagens in der organischen Chemie. Es wird in der Gasphase durch die Reaktion hergestellt:
Ein Kolben mit 3,00 l Inhalt enthält im Gleichgewicht bei 200 °C: 0,120 mol PCl5(G), 0,600 mol PCl&sub2;3(G) und 0,0120 mol CL2(G). Welchen Wert hat die Gleichgewichtskonstante bei dieser Temperatur?
Richtige Antwort: 50 (mol/l)-1
1. Schritt: Stellen Sie den Ausdruck der Gleichgewichtskonstante für die Reaktion zusammen.
2. Schritt: Berechnen Sie die Konzentrationen in mol/L jeder Komponente im Gleichgewicht.
Molare Konzentrationsformel:
| PCl3 | Cl2 | PCl5 |
3. Schritt: Ersetzen Sie die Konzentrationen im konstanten Ausdruck und berechnen Sie den Wert von Kç.
Anwendungen für Gleichgewichtsgleichgewicht
9. (Enem/2016) Nach der vollständigen Abnutzung können die Reifen zur Energiegewinnung verbrannt werden. Unter den Gasen, die bei der vollständigen Verbrennung von vulkanisiertem Gummi entstehen, sind einige Schadstoffe und verursachen sauren Regen. Um zu verhindern, dass sie in die Atmosphäre entweichen, können diese Gase in eine wässrige Lösung geperlt werden, die eine geeignete Substanz enthält. Beachten Sie die in der Tabelle aufgeführten Stoffinformationen.
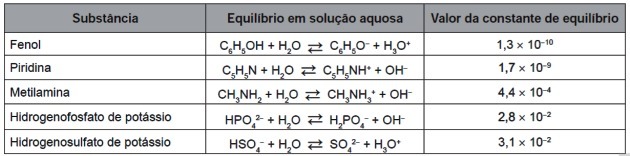
Unter den in der Tabelle aufgeführten Stoffen ist der Stoff, der Schadstoffe am effizientesten entfernt, (a)
a) Phenol.
b) Pyridin.
c) Methylamin.
d) Kaliumhydrogenphosphat.
e) Kaliumhydrogensulfat.
Richtige Antwort: d) Kaliumhydrogenphosphat.
das CO2, Schwefeloxide (SO2 und so3) und Stickoxide (NO und NO2) sind die wichtigsten Schadstoffe.
Wenn sie mit Wasser in der Atmosphäre reagieren, gibt es eine Säurebildung die zu einer Erhöhung des Säuregehalts des Regens führen, weshalb er als saurer Regen bezeichnet wird.
Die in der Tabelle angegebenen Gleichgewichtskonstanten werden aus dem Verhältnis der Konzentrationen von Produkten und Reagenzien wie folgt berechnet:
Beachten Sie, dass die Gleichgewichtskonstante proportional zur Produktkonzentration ist: Je größer die Produktmenge, desto größer der Wert von Kç.
Beachten Sie die Werte des ersten und letzten Verbunds in der Tabelle für Kç:
| Pyridin | ||
| Kaliumhydrogensulfat |
Beim Vergleich der beiden Zahlen sehen wir, dass der Wert der Konstanten umso größer ist, je kleiner die negative Potenz ist.
Um Schadstoffe effizienter zu entfernen, wird OH- mit H-Ionen reagieren+ in Säuren vorhanden durch a Neutralisierungsreaktion.
Zu den vorgestellten Substanzen gehören: Pyridin, Methylamin und Kaliumhydrogenphosphat.
Um herauszufinden, welche Verbindung am effizientesten ist, beobachten wir die Gleichgewichtskonstanten: Je höher der konstante Wert, desto höher die Konzentration von OH-.
Somit ist die für diesen Zweck geeignete wässrige Lösung, die eine Substanz enthält, Kaliumhydrogenphosphat, da es basischer ist und Säuren wirksamer neutralisiert.
Um mehr zu erfahren, lesen Sie diese Texte.:
- Ionengleichgewicht
- Neutralisierungsreaktion
10. (Enem/2009) Seifen sind Salze langkettiger Carbonsäuren, die verwendet werden, um bei Waschprozessen, der Entfernung von schwer wasserlöslichen Stoffen, z. B. Ölen und Fette. Die folgende Abbildung zeigt die Struktur eines Seifenmoleküls.
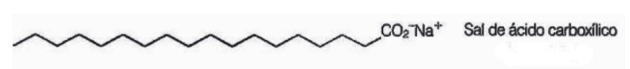
In Lösung können Seifenanionen Wasser hydrolysieren und dabei die entsprechende Carbonsäure bilden. Für Natriumstearat wird beispielsweise die folgende Bilanz aufgestellt:
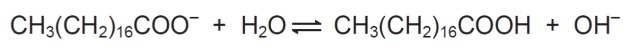
Da die gebildete Carbonsäure in Wasser schlecht löslich und weniger effizient bei der Entfernung von Fetten ist, der pH-Wert des Mediums muss so kontrolliert werden, dass das obige Gleichgewicht nicht nach rechts verschoben wird.
Basierend auf den Informationen im Text ist es richtig, zu schließen, dass Seifen auf eine Weise wirken:
a) Effizienter bei basischem pH.
b) Effizienter bei saurem pH.
c) Effizienter bei neutralem pH.
d) Effizient über jeden pH-Bereich.
e) Effizienter bei saurem oder neutralem pH.
Antwort: a) Effizienter bei basischem pH.
In der gezeigten Bilanz sehen wir, dass Natriumstearat bei der Reaktion mit Wasser eine Carbonsäure und Hydroxyl bildet.
Der Zweck der pH-Kontrolle besteht darin, die Bildung von Carbonsäure zu verhindern, und dies geschieht durch eine Verschiebung des Gleichgewichts durch Änderung der OH-Konzentration-.
desto mehr OH- in Lösung kommt es auf der Produktseite zu einer Störung und das chemische System reagiert, indem es den aufkonzentrierten Stoff, in diesem Fall das Hydroxyl, verzehrt.
Folglich kommt es zur Umwandlung von Produkten in Reagenzien.
Daher wirken Seifen am effizientesten bei basischem pH-Wert, da überschüssiges Hydroxyl das Gleichgewicht nach links verschiebt.
Wenn der pH-Wert sauer wäre, würde die H .-Konzentration höher sein+ das würde das Gleichgewicht durch den Verbrauch von OH. beeinflussen- und das Gleichgewicht würde wirken, indem es mehr Hydroxyl produziert, das Gleichgewicht nach links verschiebt und mehr Carbonsäure produziert, was bei dem vorgestellten Verfahren nicht von Interesse ist.
Verschiebung des chemischen Gleichgewichts
11. (Enem/2011) Erfrischungsgetränke sind zunehmend zum Ziel der öffentlichen Gesundheitspolitik geworden. Kleberprodukte enthalten Phosphorsäure, eine Substanz, die für die Fixierung von Calcium schädlich ist, dem Mineral, das den Hauptbestandteil der Zahnmatrix darstellt. Karies ist ein dynamischer Prozess des Ungleichgewichts im Prozess der Demineralisierung der Zähne, Verlust von Mineralien durch Säure. Es ist bekannt, dass der Hauptbestandteil des Zahnschmelzes ein Salz namens Hydroxyapatit ist. Das Soda senkt aufgrund des Vorhandenseins von Saccharose den pH-Wert des Biofilms (bakterieller Plaque) und verursacht die Demineralisierung des Zahnschmelzes. Die Abwehrmechanismen des Speichels brauchen 20 bis 30 Minuten, um den pH-Wert zu normalisieren und den Zahn zu remineralisieren. Die folgende chemische Gleichung repräsentiert diesen Vorgang:
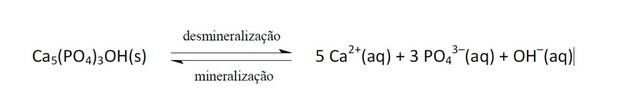 GROISMANN, S. Die Wirkung von Soda auf die Zähne wird beurteilt, ohne es aus der Ernährung zu nehmen. Verfügbar in: http://www.isaude.net. Eingesehen am: 1. Mai 2010 (angepasst).
GROISMANN, S. Die Wirkung von Soda auf die Zähne wird beurteilt, ohne es aus der Ernährung zu nehmen. Verfügbar in: http://www.isaude.net. Eingesehen am: 1. Mai 2010 (angepasst).
Wenn man bedenkt, dass eine Person täglich Erfrischungsgetränke zu sich nimmt, kann aufgrund der erhöhten Konzentration von
a) OH–, das mit Ca-Ionen reagiert2+, verschiebt das Gleichgewicht nach rechts.
b) H+, das mit den OH-Hydroxylen reagiert–, verschiebt das Gleichgewicht nach rechts.
c) OH–, das mit Ca-Ionen reagiert2+, verschiebt das Gleichgewicht nach links.
d) H+, das mit den OH-Hydroxylen reagiert–, verschiebt das Gleichgewicht nach links.
e) Ca2+, das mit den OH-Hydroxylen reagiert–, verschiebt das Gleichgewicht nach links.
Richtige Antwort: b) H+, das mit den OH-Hydroxylen reagiert–, verschiebt das Gleichgewicht nach rechts.
Wenn der pH-Wert sinkt, liegt dies daran, dass der Säuregehalt zugenommen hat, d. h. die Konzentration an H-Ionen+, wie die Aussage sagt, gibt es das Vorhandensein von Phosphorsäure.
Diese Ionen reagieren mit OH- Dies führt dazu, dass diese Substanz verbraucht wird und folglich das Gleichgewicht nach rechts verschoben wird, da das System mehr dieser entfernten Ionen produziert.
Die Gleichgewichtsverschiebung zwischen Edukten und Produkten erfolgte aufgrund der Abnahme der OH-Konzentration-.
Wenn die Ca-Ionen2+ und oh- würde die Konzentration erhöht, würde das Gleichgewicht nach links verschieben, da das System reagieren würde, indem es sie konsumierte und mehr Hydroxyapatit bildete.
Die Änderung der vorherigen Bilanz in Bezug auf Kältemittelleckagen unter den beschriebenen Bedingungen führt zu:
a) CO-Freisetzung2 Für die Umwelt.
b) Erhöhen der Temperatur des Behälters.
c) Erhöhung des Innendrucks des Behälters.
d) Erhöhung der CO-Konzentration2 in der Flüssigkeit.
e) Bildung einer signifikanten Menge an H2Ö.
Richtige Antwort: a) CO-Freisetzung2 Für die Umwelt.
Im Inneren der Flasche wurde das Kohlendioxid aufgrund des hohen Drucks in der Flüssigkeit gelöst.
Beim Öffnen der Flasche entspricht der Druck im Behälter (der größer war) dem Druck in der Umgebung und damit entweicht Kohlendioxid.
Die Gleichgewichtsverschiebung zwischen Edukten und Produkten erfolgte aufgrund des Druckabfalls: Wenn der Druck abnimmt, verschiebt sich das Gleichgewicht zum größten Volumen (Molzahl).
Die Reaktion verschob sich nach links und das CO2 das in der Flüssigkeit gelöst war, wurde freigesetzt und trat beim Öffnen der Flasche aus.