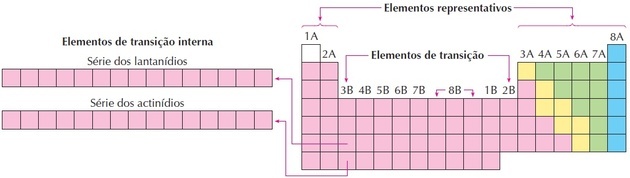
Die Struktur eines Atoms ist komplex und voller Details. Viele Jahre lang widmeten mehrere Wissenschaftler auf der ganzen Welt einen Teil ihres Lebens der Erforschung der Konstitution eines Atoms und der Erstellung von Modellen und Theorien. Dank dessen haben wir derzeit Kenntnisse über mehrere Details des atomaren Aufbaus:
Ein Kern mit Protonen und Neutronen – vorgeschlagen von Rutherford bzw. Chadwick;
Energieniveaus oder elektronische Schichten – vorgeschlagen von Bohr;
Energieunterebenen (Energieebenenunterregionen) - vorgeschlagen von Sommerfeld;
Atomorbitale (wahrscheinlicher Ort, um ein Elektron zu finden) – vorgeschlagen von Erwin Schrödinger.
Regionen um den Kern (Ebenen, Unterebenen und Orbitale) haben eine große Relevanz, denn durch die Kenntnis dieser Bereiche war es möglich, zu wissen das Phänomen der Fluoreszenz, Phosphoreszenz, die Art und Weise, wie eine chemische Bindung auftritt, und einige physikalische Eigenschaften von Materie (Magnetismus).
Sehen Sie, wie die Regionen des Atoms organisiert sind:
█ Ebenen
Das Atom hat insgesamt sieben Ebenen, dargestellt durch die Buchstaben K, L, M, N, O, P, Q, jeweils mit einer bestimmten Energiemenge.
█ Unterebenen
Jede Ebene hat eine bestimmte Anzahl von Unterebenen, die durch nur vier Buchstaben dargestellt werden: s, p, d, f.
K - 1 Unterebene(n)
L - 2 Unterebenen (s, p)
M - 3 Unterebenen (s, p, d)
N - 4 Unterebenen (s, p, d, f)
O- 4 Unterebenen (s, p, d, f)
P - 3 Unterebenen (s, p, d)
Q - 2 Unterebenen (s, p)
█ Orbitale
Jeder Unterebene präsentiert eine andere Menge von Orbitale:
s = 1orbital
p = 3Orbitale
d = 5Orbitale
f =7Orbitale
Überwachung: In jedem Orbital können wir höchstens zwei Elektronen finden. Somit ist die maximale Anzahl von Elektronen in einer Unterebene:
s = 2Elektronen
p = 6Elektronen
d = 10Elektronen
f = 14Elektronen
Mit all diesen Informationen hat der amerikanische Chemiker Linus Carl Pauling ein Tool entwickelt, um die Elektronen verteilen eines Atoms praktischer auf dem Papier. Dieses wichtige Werkzeug hieß Linus Pauling-Diagramm. In diesem Diagramm haben wir nur Ebenen und Unterebenen. Sehen Sie sich eine Gliederung an:
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)

die Striche in Rosa und Orange sie legen eine Energieordnung fest, die sich durch das gesamte Diagramm zieht. Diese Reihenfolge beginnt mit dem Bindestrich, der eingeht 1s und folgt a diagonaler Verlauf bis zum Erreichen 7p. Jede folgende diagonale Linie zeigt Unterniveaus mit mehr Energie als die der vorherigen Linie an. Die Unterebene weiter unten auf derselben diagonalen Linie hat immer mehr Energie als die vorherige. So:
2s haben mehr Energie dass 1s (in verschiedenen diagonalen Strichen vorhanden);
4p hat mehr Energie als 3d (im gleichen diagonalen Strich vorhanden).
Um die Verteilung der Elektronen durch das Pauling-Diagramm durchzuführen, ist es notwendig, dass Anzahl der Elektronen eines Atoms, folge den diagonalen Linien und respektiere die maximale Anzahl von Elektronen in jeder Unterebene. Sehen Sie einige Beispiele:
— Elektronenverteilung ab Z = 20 (20 Elektronen)

Elektronenverteilung eines Atoms mit 20 Elektronen
— Elektronenverteilung ab Z = 59 (59 Elektronen)

Elektronenverteilung eines Atoms mit 59 Elektronen
Mögen Linus Pauling-Diagramm, können folgende Aufgaben ausgeführt werden:
Verteile alle Elektronen in einem Atom;
Sagen Sie die Regionen mit der niedrigsten und höchsten Energie des Atoms voraus (Elektronen sind im Atom so verteilt, dass sie immer Bereiche niedrigerer Energie einnehmen);
Sagen Sie die Anzahl der Ebenen eines Atoms aus seiner Ordnungszahl (Z) voraus;
Sagen Sie die Klassifizierung eines Atoms anhand seiner Ordnungszahl (Z) voraus.
Bestimmen Sie die Anzahl der Bindungen, die das Atom eingehen muss, um Stabilität zu erreichen.
¹ Bildnachweis: Shutterstock / Laufsteg
Von mir. Diogo Lopes Dias
Möchten Sie diesen Text in einer schulischen oder wissenschaftlichen Arbeit referenzieren? Aussehen:
TAGE, Diogo Lopes. "Linus Pauling-Diagramm"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/diagrama-linus-pauling.htm. Zugriff am 28. Juni 2021.
Chemie

Niels Bohr, Bohrs Atom, Atomphysik, stabiles Atom, Atommodell, Planetensystem, Schichten der Elektrosphäre, Energieniveaus, Elektronenhüllen, Elektronenenergie, Rutherford-Atommodell, Atom im angeregten Zustand.
Chemie

Atome und der Aufbau des Universums, Atomtheorie, dass alles gemacht ist, Materie besteht aus Atomen, Theorie der vier Elemente, alte Alchemisten, Atomtheorie, fundamentale Teilchen.