Chloride sind jene ionischen Verbindungen, die das Anion enthalten Cℓ-1.
Chlor gehört zur Familie der 17 oder 7A, seine Ordnungszahl ist gleich 17 und es hat 7 Elektronen in der Valenzschale (der äußersten Elektronenschale des Atoms). Gemäß Regel des Oktetts, um stabil zu sein, muss es 8 Elektronen in dieser letzten Schale haben und muss daher ein weiteres Elektron aufnehmen. Wenn dies geschieht, das heißt, wenn es ein Elektron im Allgemeinen aus einer ionischen Bindung mit einem Metall erhält, wird das â gebildet.Chlorid (Cℓ-1), wird das Metall, das das Elektron abgegeben hat, zu einem Kation und die gebildete Substanz ist ionisch.
Chloride sind Salze, die aus der Reaktion einer Base mit Salzsäure (HCℓ(Hier)). Die Base liefert das Kation und Salzsäure liefert das Chloridion:
Generische Base + Salzsäure → Chlorid + Wasser
ÇOH+HCℓ → ÇCℓ + H2Ö
Chloride sind alle klassifiziert als anorganische Salze, weil sie in wässrigem Medium ein anderes Kation als H. freisetzen+ und setzen das Chloridanion frei, nicht das Hydroxyl (OH-).
Die Nomenklatur der Chloride folgt immer dieser Regel: Chlorid +de + (Name des mit Chlor verbundenen Elements). Beim deine Formeln sind gebildet Austausch der Ionenladungen gegen die Indizes (Zahl, die sich unten rechts im Elementsymbol befindet und die Anzahl der Atome dieses Elements angibt, die vorhanden sind und Bindungen eingehen).
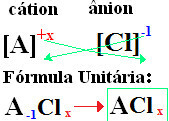
wenn der Index "1" ist, müssen Sie ihn nicht in die Formel schreiben, wie unten gezeigt:
Beim+1 Cℓ-1 → Beim1Cℓ1 → BeimCℓ: Natriumchlorid;
K+1 Cℓ-1 → KCℓ: Kaliumchlorid;
Hier+2 Cℓ-1→CaCℓ2: Calciumchlorid;
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Ba+2 Cℓ-1→BHier2: Bariumchlorid;
Aℓ+3 Cℓ-1→ACℓ3: Aluminiumchlorid.
Aber wie im Text erklärt „Ionische Stoffe der Gruppe: Chlorid, Carbonat, Nitrat und Sulfat“, wie bei allen ionischen Substanzen haben Chloride ihre Einheitsformeln in der Natur nicht isoliert, da sich ihre Ionen gegenseitig anziehen und die Kristallgitter bilden.
Das wichtigste Beispiel für Chlorid, das wir in unserem täglichen Leben haben, ist das Natriumchlorid, NaCl, das Kochsalz. Sehen Sie sich die Ionenbindung an, die zu seiner Bildung führt (bei der Natrium ein Elektron an Chlor abgibt) und unter dem Kristallgitter dieses Salzes:
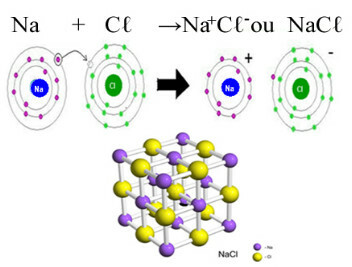
Im Kristallgitter von Natriumchlorid ist jedes Anion Cℓ- ist umgeben von 6 Kationen Na+ und umgekehrt, die Koordinationszahl dieses Kristallgitters ist also 6.
Alle Chloride sind Feststoffe bei Umgebungsbedingungen und ruhig wasserlösliches, eines der am häufigsten vorkommenden Salze in unserem täglichen Leben, wenn man bedenkt, dass mehrere von ihnen sind gelöst in Mineralwasser, Trinkwasser, Leitungswasser, Flüssen, Meeren u Andere. Zu den Ausnahmen, die wasserunlösliche Chloride sind, zählen Silberchlorid (AgCℓ - gezeigt in der folgenden Abbildung), von Blei, Kupfer und Quecksilberverbindungen.

Wasserunlösliches Silberchlorid*
Die Cℓ-Ionen-1 aus den Chloriden, die wir aufnehmen, hauptsächlich in den Salz, Fisch und Fleisch, sind für einige Funktionen des menschlichen Körpers wichtig, da sie das wichtigste extrazelluläre Anion sind und im Saft vorhanden sind Magen, regulieren Körperflüssigkeiten, wie die Wasserverteilung im Körper, und halten den osmotischen Plasmadruck und die Neutralität aufrecht elektrisch.
Sein Mangel kann Angstzustände, Durchfall und Kreislaufprobleme verursachen. Sein Überschuss wird über den Urin (im Durchschnitt scheidet jeder Mensch etwa 4 g Chlorid pro Tag), Schweiß und Kot ausgeschieden.
*Bildnachweis: Autor: Danny S. / Bild extrahiert aus: Wikimedia Commons
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Chloride"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/cloretos.htm. Zugriff am 28. Juni 2021.
Chemie

Alltagssalze, Calciumcarbonat, Natriumchlorid, Natriumfluorid, Kaliumnitrat, Natriumnitrat Natrium, Natriumcarbonat, Natriumbicarbonat, Natriumbicarbonat, Natriumsulfit, Salpeter, Sprudel.



