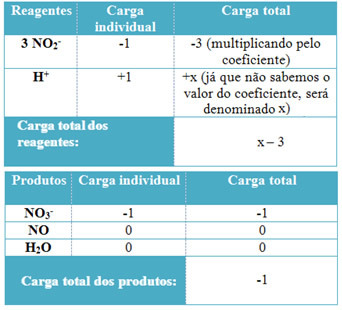
Wenn wir das Wort „Balance“ sagen, kommt uns ein Objekt in den Sinn, das auf unbestimmte Zeit bleibt. Dies ist jedoch nur eine Art von Gleichgewicht, genannt „statisches Gleichgewicht“.
Es gibt auch die "dynamisches Gleichgewicht". Darin gibt es, wie der Name schon sagt, keinen einzigen Moment, in dem das betreffende Objekt oder Phänomen still ist. Sehen Sie sich zum Beispiel zum besseren Verständnis die folgende Abbildung an und beachten Sie, dass die Wassermenge, die in den Behälter fällt, gleich der Menge ist, die aus ihm herausfließt, wobei der Wasserstand konstant gehalten wird. In diesem Fall sagen wir, dass es a dynamisches Gleichgewicht, ein Gleichgewicht in Bewegung.

Es ist diese Art von Gleichgewicht, das in auftritt reversible Reaktionen, also bei den Reaktionen, die in beide Richtungen ablaufen. Gleichzeitig mit der Umwandlung der Moleküle der Reaktionspartner in die Produkte reagieren die Moleküle der Produkte miteinander zu den Reaktionspartnern. Die Reversibilität einer Reaktion wird durch Pfeile in beide Richtungen dargestellt:
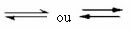
In dem Moment, in dem die Entwicklungsgeschwindigkeit der direkten Reaktion (der Bildung der Produkte) gleich der Entwicklungsgeschwindigkeit der Umkehrreaktion (Reaktandenbildung) bei konstanter Temperatur bedeutet, dass die Reaktion ihr Gleichgewicht erreicht hat chemisch. Und im Falle von Reaktionen, bei denen nur Moleküle in den Reaktanten und Produkten vorhanden sind, haben wir a molekulares Gleichgewicht.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
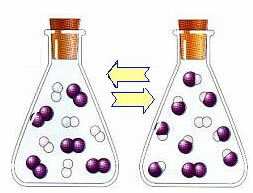
Das Folgende ist ein Beispiel für die Reaktion, die zwischen Wasserstoffgas (H2) und Jodgas (I2), zur Bildung von Jodwasserstoff (HI)-Gas:
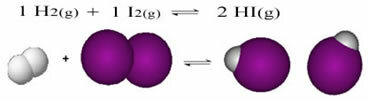
Zu Beginn der Reaktion war die Entwicklungsgeschwindigkeit der direkten Reaktion höher, immerhin war die Konzentration der Edukte maximal und die der Produkte Null. Die Entwicklungsgeschwindigkeit der Rückreaktion war also ebenfalls Null.
Im Laufe der Zeit reagieren jedoch die Gase Wasserstoff und Jod und erzeugen das Produkt. Auf diese Weise beginnt die Konzentration der Reagenzien zu sinken und ihre Entwicklungsgeschwindigkeit nimmt ebenfalls ab.
Wenn die Konzentration der Produkte zunimmt und die Konzentration der Reaktanten abnimmt, beginnt die Entwicklungsgeschwindigkeit der inversen Reaktion zu steigen. Wenn die Temperatur konstant gehalten wird, werden die beiden Entwicklungsgeschwindigkeiten irgendwann gleich bleiben, was zeigt, dass die Reaktion ein chemisches molekulares Gleichgewicht erreicht hat.
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Molekulares Gleichgewicht"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Zugriff am 28. Juni 2021.