Batterie ist ein Gerät, in dem ein elektrischer Strom aus chemischer Energie erzeugt wird, die von einem Oxidoreduktionsreaktiond. h. eine Spezies des Reaktanten verliert Elektronen (Oxidation), während eine andere Spezies Elektronen aufnimmt (Reduktion).
Siehe Darstellungen der Oxidations- und Reduktionsreaktionen, die in jedem Stapel auftreten:
Oxidation: X → und + X+
Spezies X verliert ein Elektron und wird zu einem Kation.
Die Ermäßigung: Ja- + und → Y
das Y-Anion- nimmt Elektron auf und wandelt sich in eine neutrale Y-Spezies um.
Grundkomponenten eines Stacks
Die Grundkomponenten eines Stapels sind:
Anode: negative Elektrode, in der die Oxidationsreaktion stattfindet, dh Elektronenverlust;
Kathode: positive Elektrode, in der die Reduktionsreaktion stattfindet, dh die Elektronenverstärkung;
Elektrolytlösung (Salzbrücke) oder ein leitfähiges Material (wie ein Graphitstab): ist das Mittel, durch das von der Anode abgegebene Elektronen die Kathode erreichen.
Grundlagen zur Funktionsweise einer Batterie
Die Funktion eines Stacks erfolgt aus den folgenden Ereignissen:
1. Prinzip: Anodenoxidation
Das Metall in der Anode wird, da es eine größere Tendenz hat, Elektronen zu verlieren, zu einem Kation, wie wir in der folgenden Gleichung beobachtet haben:
Zn → Zn2+ + 2 und
2. Prinzip: Kathodenreduktion
Die Kationen, die Teil des in der Kathode vorhandenen Materials sind (wir verwenden Kupfer als Beispiel), wenn sie erhalten die Elektronen der Anode wandeln sich in metallisches Kupfer um, wie wir in der Gleichung sehen können unten:
Arsch2+ + 2e → Cu
erste Haufen
a) Alessandro Voltas Batterie
Alessandros Stapelrücken (der erste Stapel in der Geschichte), der 1800 zusammengebaut wurde, wurde aus eingelagerten Metallscheiben gebildet, wie in der Abbildung unten:

Montage ähnlich wie bei Alessandros Back to your Pile
Die Scheiben waren verschachtelt, weil sie eine unterschiedliche Zusammensetzung hatten. Einer war aus Zinkmetall und der andere aus Kupfer, immer getrennt durch in Salzlake getränkte Baumwolle (eine Lösung aus Wasser und Salz).
B) Daniells Haufen
Daniells Stapel, der 1836 zusammengebaut wurde, bestand aus zwei Halbzellen, die durch einen leitenden Draht und eine Salzbrücke verbunden waren.
Halbzelle 1: Es war die Anode, dh der Minuspol der Batterie.
Es bestand aus einer Zinkplatte, und ein Teil dieser Platte wurde in eine Lösung getaucht, die aus Wasser und Zinksulfat (ZnSO4).
Halbzelle 2: es war die Kathode, also der Pluspol der Batterie.
Es bestand aus einer Kupferplatte, und ein Teil dieser Platte wurde in eine Lösung getaucht, die aus Wasser und Kupfersulfat (CuSO4).
Salzbrücke
U-förmiges Rohr, das eine aus Wasser und Kaliumchlorid (KCl) gebildete Lösung enthielt, die die beiden Halbzellen (Zink und Kupfer) verband und an beiden Enden eine Glaswolle hatte.
Batterien aktuell
Derzeit gibt es mehrere Modelle von Stacks, aber im Allgemeinen sehen sie so aus:
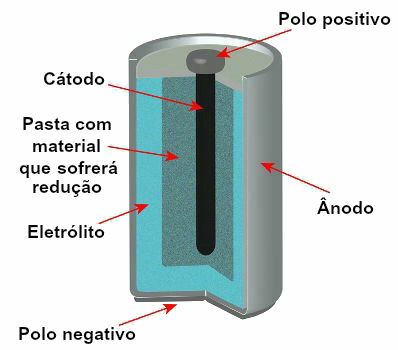
Schematische Darstellung des Modells eines aktuellen Stapels
Die am häufigsten verwendeten Modelle sind die sogenannte Leclanché-Batterie und die Alkalibatterie, die folgende Unterschiede aufweisen:
Das) Leclanche-Haufen
Es hat eine Anode aus metallischem Zink;
Es hat eine Kathode, die aus einer Paste mit Ammoniumchlorid, Wasser, Stärke und Mangandioxid besteht;
Es hat einen Graphitstab, der als Leiter für die Elektronen dient, die von der Kathode zur Anode gehen.
B) Alkaline Batterie
Es hat eine Anode aus metallischem Zink oder Cadmium;
Es hat eine Kathode, die aus Quecksilberoxid, Nickeloxid und Jod besteht;
Es muss eine gemischte Basis in dem Material haben, aus dem die Kathode besteht.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm