Ö Berechnung der Anzahl der Atomteilchen wird verwendet, um die Menge an Protonen (im Kern), Elektronen (in der Elektrosphäre) und Neutronen (im Kern) in einem Atom oder Ion anzugeben. Dazu ist es wichtig, einige Eigenschaften von Atomen zu kennen:
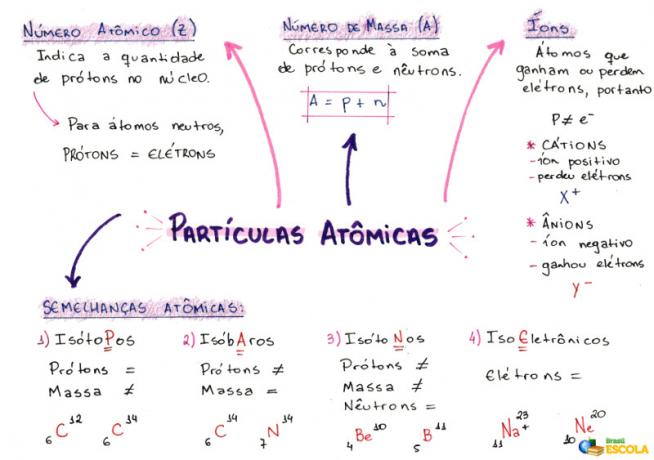
1- Ordnungszahl (Z)
Es ist ein mathematischer Code, dargestellt durch den Großbuchstaben Z, der sich auf der unteren linken Seite der Abkürzung eines Atoms befindet:
ZX
Sie gibt die Anzahl der Protonen (p) im Kern und die Anzahl der Elektronen (e) in der Elektrosphäre eines Atoms an. Also allgemein:
Z = p = e
2- Massenzahl (A)
Es ist ein mathematischer Code, der der Summe der Anzahl der Protonen (p) und Neutronen (n) entspricht, die beide im Kern eines beliebigen Atoms vorhanden sind. Die Gleichung, die die Massenzahl darstellt, ist gegeben durch:
A = p + n
Da die Anzahl der Protonen gleich der Ordnungszahl ist, können wir die Gleichung zur Berechnung der Massenzahl wie folgt schreiben:
A = Z + n
Wenn wir die Massenzahl und die Ordnungszahl eines Atoms kennen, können wir die Neutronenzahl wie folgt bestimmen:
n = A - Z
3- Ionen
Sie sind Atome, die Elektronen verlieren oder aufnehmen. Sie haben oben rechts in ihrer Darstellung ein positives oder negatives Vorzeichen, wie im folgenden Modell:
X+ oder X-
Positives Ion: Dies wird als Kation bezeichnet und das positive Vorzeichen zeigt an, dass es Elektronen verloren hat.
Negatives Ion: Dies wird als Anion bezeichnet und das negative Vorzeichen zeigt an, dass es Elektronen aufgenommen hat.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
4- Atomare Ähnlichkeiten
a) Isotope
Atome mit gleicher Ordnungszahl und unterschiedlichen Massenzahlen. Beispiel:
7X14 und 7Ja16
Die Atome X und Y haben die gleiche Ordnungszahl (links vom Akronym), also gleich 7. Atom X hat eine Massenzahl (rechts vom Akronym) gleich 14, und Atom Y hat eine Massenzahl gleich 16.
b) Isobaren
Atome mit gleicher Massenzahl und unterschiedlichen Ordnungszahlen. Beispiel:
15X31 und 13Ja31
Die Atome X und Y haben eine Massenzahl (rechts neben dem Akronym) von 31. Andererseits hat Atom X eine Ordnungszahl gleich 15 und Atom Y hat eine Ordnungszahl gleich 13.
c) Isotone
Atome mit unterschiedlichen Massenzahlen und Ordnungszahlen, aber derselben Neutronenzahl.
d) Isoelektronik
Atome mit der gleichen Anzahl von Elektronen. Beispiel:
12X+2 und 7Ja-3
Atom X hat eine Ordnungszahl gleich 12 und ist ein Kation (mit einer positiven Ladung +2), daher verliert es zwei Elektronen und hat somit 10 Elektronen in seiner Elektrosphäre. Atom Y hingegen hat eine Ordnungszahl von 7 und ist ein Anion (mit einer negativen Ladung -3), nimmt also drei Elektronen auf und hat somit 10 Elektronen in seiner Elektrosphäre.
Mindmap: Atompartikel
* Um die Mindmap als PDF herunterzuladen, Klicke hier!
Beispiele für die Berechnung der Anzahl der Atomteilchen
Beispiel 1: Bestimmen Sie die Anzahl der Protonen, Neutronen und Elektronen im Atom 14X29.
Folgende Werte für Atom X wurden angegeben:
Massenzahl (oben rechts) = 29
Ordnungszahl (unten links) = 14
Um die Anzahl der Protonen zu bestimmen:
Die Anzahl der Protonen ist immer gleich der Ordnungszahl, das X-Atom hat also 14 Protonen.
Um die Anzahl der Elektronen zu bestimmen:
Da das Atom X kein Ion ist, ist die Anzahl der Elektronen gleich der Anzahl der Protonen, also 14.
Um die Neutronenzahl zu bestimmen:
Die Neutronenzahl wird anhand der Masse- und Protonenzahl in folgender Formel bestimmt:
A = p + n
29 = 14 + n
29 - 14 =n
n = 15
Beispiel 2: Bestimmen Sie die Anzahl der Protonen, Neutronen und Elektronen des Ions X+3, wissend, dass ihre Massenzahl und Ordnungszahl 51 bzw. 23 sind.
Folgende Werte für das Ion X wurden angegeben:
Massenzahl = 51
Ordnungszahl (unten links) = 23
Um die Anzahl der Protonen zu bestimmen:
Die Anzahl der Protonen ist immer gleich der Ordnungszahl, das X-Atom hat also 23 Protonen.
Um die Anzahl der Elektronen zu bestimmen:
Das Ion X ist positiv (+3), also ein Kation, das drei Elektronen verloren hat. Seine Elektronenzahl beträgt also 20.
HINWEIS: Die Verringerung oder Erhöhung der Elektronenzahl erfolgt immer im Verhältnis zur Ordnungszahl.
Um die Neutronenzahl zu bestimmen:
Die Neutronenzahl wird anhand der Masse- und Protonenzahl in folgender Formel bestimmt:
A = p + n
51 = 23 + n
51 - 23 =n
n = 28
Beispiel 3: Ein Atom W hat eine Ordnungszahl und eine Masse von 29 bzw. 57 und ist isobar von a Atom Y, das eine Ordnungszahl gleich 30 hat, das Isotop eines Atoms B ist, dessen Massenzahl. ist 65. Bestimmen Sie mit diesen Informationen die Anzahl der Protonen, Neutronen und Elektronen im Atom B.
Von der Übung bereitgestellte Daten:
Atom W
Ordnungszahl (unten links) = 29
Massenzahl (oben rechts) = 57
Y isobar, dh die Masse von Y beträgt ebenfalls 57.
Y-Atom
Ordnungszahl = 30
Massenzahl = 57
Mit diesen beiden Werten müssen wir seine Neutronenzahl bestimmen, da es sich um ein Isoton von Element B handelt:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Grabmal:
Massenzahl = 65
Anzahl Neutronen = 27
Mit diesen Daten müssen wir seine Ordnungszahl bestimmen, denn damit bestimmen wir seine Protonen- und Elektronenzahl (da es kein Ion ist):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Daher hat das Atom B 38 Protonen, 38 Elektronen und 27 Neutronen.
* Mindmap von Victor Ricardo Ferreira
Chemielehrer
Von mir. Diogo Lopes Dias


