DAS ZuerstRechtgibtThermodynamik ist eine Anwendung von PrinzipgibtErhaltunggibtEnergie für thermodynamische Systeme. Nach diesem Gesetz ist die Variation von innere Energie eines thermodynamischen Systems ist die Differenz zwischen der Menge an Hitze vom System aufgenommen und die von ihm geleistete Arbeit.
Aussehenebenfalls:Grundlegende Konzepte und Zusammenfassung der Thermologie
Was ist der erste Hauptsatz der Thermodynamik?
Der erste Hauptsatz der Thermodynamik ist eine direkte Folge des Energieerhaltungssatzes. Nach diesem Prinzip ist die Gesamtenergie eines Systemsbleibt immer konstant, da sie nicht verloren, sondern verwandelt ist.
Im Rahmen von Thermodynamik, werden verwendet spezifischere Begriffe und weniger allgemein als diejenigen, die beim Energieerhaltungssatz verwendet werden. Im ersten Hauptsatz der Thermodynamik verwenden wir Konzepte wie Energieintern,Hitze und Arbeit, die für den Anwendungsbereich relevant sind Thermische Maschinen (Technologische Anwendungen von grundlegender Bedeutung für die Thermodynamik).

Stellen Sie sich eine dampfbetriebene Maschine vor, wenn das Arbeitsmedium dieser Maschine (Wasserdampf) Wärme von einer externen Quelle erhält, sind zwei Energieumwandlungen möglich: Dampf kann seine eigene haben Temperatur um einige Grad erhöht oder kann sogar erweitern und bewegen Sie die Kolben dieser Maschine, wodurch eine bestimmte Menge von Arbeit.
"Die Variation der inneren Energie eines thermodynamischen Systems entspricht der Differenz zwischen der von ihm aufgenommenen Wärmemenge und der Arbeit, die dieses System verrichtet."
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Formel des ersten Hauptsatzes der Thermodynamik
Die Formel zur mathematischen Beschreibung des ersten Hauptsatzes der Thermodynamik ist unten dargestellt:

U – interne Energievariation (cal oder J)
Q – Hitze (Kalk oder J)
τ – Arbeit (Kalk oder J)
Um diese Formel zu verwenden, müssen wir einige Signalregeln beachten:
U – wird positiv, wenn die Systemtemperatur steigt;
U – wird negativ, wenn die Systemtemperatur sinkt;
Q – ist positiv, wenn das System Wärme aus der äußeren Umgebung aufnimmt;
Q – es ist negativ, wenn das System Wärme an die äußere Umgebung abgibt;
τ – es wird positiv sein, wenn das System erweitert wird und Arbeiten an der externen Umgebung durchgeführt werden;
τ – es ist negativ, wenn sich das System zusammenzieht und Arbeit von der externen Umgebung erhält.
Variation der inneren Energie
Der Begriff ΔU bezieht sich auf die Energieänderung, die dem. zugeschrieben wird kinetische Energie der konstituierenden Teilchen des Systems kann im Fall eines idealen Gases gesagt werden, dass ΔU äquivalent ist zu:
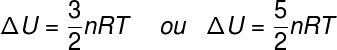
Nein – Molzahl (Mol)
R – universelle Konstante idealer Gase (0,082 atm.l/mol. K oder 8,31 J/mol. K)
T – absolute Temperatur (Kelvin)
Wenn man die Formeln analysiert, kann man sehen, dass, wenn es keine Temperaturänderung im System gibt, seine innere Energie wird auch unverändert bleiben. Außerdem ist es wichtig zu sagen, dass bei thermischen Maschinen, die in Zyklen arbeiten, die Variation der inneren Energie am Ende jedes Zyklus muss null sein, da der Motor zu diesem Zeitpunkt wieder mit der Anfangstemperatur arbeitet.
Aussehenebenfalls:Leistung thermischer Maschinen: Wie wird sie berechnet?
Hitze
Kommen wir zum nächsten Term Q, der sich auf die an das System übertragene Wärmemenge bezieht, verwenden wir normalerweise die Grundgleichung der Kalorimetrie, unten gezeigt:
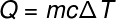
Q -Hitze (Limette oder J)
ich – Masse (g oder kg)
ç – spezifische Wärme (cal/gºC oder J/kg. K)
T – Temperaturschwankung (Celsius oder Kelvin)
Arbeit
Die letzte der Größen im Zusammenhang mit dem ersten Hauptsatz der Thermodynamik ist die Arbeit (τ), die a analytische Formel nur für Transformationen, die unter konstantem Druck auftreten, auch bekannt mögen isobare Transformationen, Uhr:
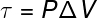
P – Druck (Pa oder atm)
V – Volumenvariation (m³ oder l)
Wenn der auf das System ausgeübte Druck nicht konstant ist, kann die Arbeit anhand der Fläche des Druck-Volumen-Diagramms (P x V) berechnet werden. Um mehr über diese Skalargröße zu erfahren, besuchen Sie: Arbeit.
gelöste Übungen
Frage 1)(CefetMG) Die in einem geschlossenen thermischen Kreislauf geleistete Arbeit beträgt 100 J, und die beim Wärmeaustausch beteiligte Wärme beträgt 1000 J bzw. 900 J mit heißen und kalten Quellen.
Nach dem ersten Hauptsatz der Thermodynamik ist die Variation der inneren Energie in diesem Wärmezyklus in Jouleule
a) 0
b) 100
c) 800
d) 900
e) 1000
Auflösung
Alternative u.
Lassen Sie uns die Übung mit dem ersten Hauptsatz der Thermodynamik lösen, beachten Sie:

Gemäß der Aussage sollen wir die Variation der inneren Energie in einem geschlossenen thermodynamischen Kreislauf berechnen, wobei wir wissen, dass die Die interne Energieschwankung muss Null sein, da die Maschine wieder mit der gleichen Temperatur wie zu Beginn des Zyklus arbeitet.
Frage 2)(Upf) Eine Probe eines idealen Gases dehnt sich bei einer isobaren und adiabatischen Umwandlung aus, indem sie ihr Volumen verdoppelt. Wenn man bedenkt, dass der Druck des Gases 5,10. beträgt6 Pa und sein Anfangsvolumen 2.10-5 m³ können wir sagen:
a) Die während des Prozesses vom Gas aufgenommene Wärme beträgt 25 cal.
b) Die Arbeit des Gases während seiner Expansion beträgt 100 cal.
c) Die Variation der inneren Energie des Gases beträgt –100 J.
d) Die Gastemperatur bleibt konstant.
e) Keines der oben genannten.
Auflösung
Alternative c.
Anhand der Informationen aus der Übungsanweisung werden wir den ersten Hauptsatz der Thermodynamik verwenden, um die richtige Alternative zu finden:
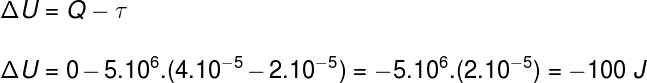
Frage 3)(Beeindruckend) Ein Kochtank enthält Hochdruckgas. Wenn wir diesen Zylinder öffnen, bemerken wir, dass das Gas schnell in die Atmosphäre entweicht. Da dieser Prozess sehr schnell ist, können wir ihn als adiabatischen Prozess betrachten.
In Anbetracht dessen, dass der Erste Hauptsatz der Thermodynamik gegeben ist durch ΔU = Q - W, wobei ΔU die Energieänderung ist im Gas ist Q die in Form von Wärme übertragene Energie und W die vom Gas geleistete Arbeit, das ist richtig behaupten, dass:
a) Gasdruck erhöht und Temperatur verringert.
b) Die vom Gas geleistete Arbeit war positiv und die Gastemperatur änderte sich nicht.
c) Die vom Gas geleistete Arbeit war positiv und die Gastemperatur nahm ab.
d) Der Gasdruck stieg an und die geleistete Arbeit war negativ.
Auflösung
Alternative c.
Sobald sich das Gasvolumen ausdehnt, sagen wir, dass die geleistete Arbeit positiv war, dh das Gas selbst hat Arbeit an der äußeren Umgebung geleistet. Da der Prozess außerdem sehr schnell abläuft, bleibt dem Gas keine Zeit, Wärme mit der Umgebung auszutauschen, sodass Folgendes geschieht:
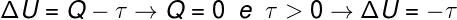
Nach der Berechnung nimmt die innere Energie des Gases um einen Betrag ab, der der geleisteten Arbeit entspricht. durch das Gas, da zusätzlich die innere Energie des Gases abnimmt, nimmt auch die ab Temperatur.
Frage 4)(Udesc) In einem Physiklabor werden Experimente mit einem Gas durchgeführt, das für thermodynamische Analysen als ideales Gas angesehen werden kann. Aus der Analyse eines der Experimente, bei denen das Gas einem thermodynamischen Prozess unterzogen wurde, wurde geschlossen, dass die gesamte dem Gas zugeführte Wärme in Arbeit umgewandelt wurde.
Kreuzen Sie die Alternative an, die darstellt korrekt der thermodynamische Prozess, der im Experiment durchgeführt wird.
a) isovolumetrischer Prozess
b) isothermer Prozess
c) isobarer Prozess
d) adiabatischer Prozess
e) zusammengesetzter Prozess: isobar und isovolumetrisch
Auflösung
Alternative b.
Damit die gesamte einem Gas zugeführte Wärme in Arbeit umgewandelt werden kann, darf keine Aufnahme von innerer Energie durch mit anderen Worten, das Gas muss einen isothermen Prozess durchlaufen, d. h. einen Prozess, der bei einer Temperatur stattfindet Konstante.
Von Rafael Hellerbrock
Physik Lehrer


