Wenn wir verschiedene Elemente der Wirkung einer Flamme aussetzen, bemerken wir, dass jedes eine andere Farbe ausstrahlt. Wenn wir zum Beispiel ein Strontium-, ein Natrium- und ein Kupfersalz verbrennen, sehen wir jeweils die Farben Rot, intensives Gelb und Grün, wie in der folgenden Abbildung gezeigt:

Wenn das Licht dieser Flammen auf ein Prisma fällt, a diskontinuierliches Spektrum, das heißt, es werden nur wenige farbige helle Linien beobachtet, die von Bereichen ohne Licht durchsetzt sind. Für jedes Element haben wir ein anderes Spektrum.

Diese Arten von Spektren heißen Emissionsspektrum, da sie von einem bestimmten Element ausgegeben wurden und zu dessen Identifizierung dienen.
Es ist möglich, solche Spektren mit einem Lichtstrahl zu erhalten, der in einer elektrischen Entladungsröhre bei hoher. erzeugt wird Temperaturen und niedrige Drücke, enthaltend Gase bestimmter Elemente wie Wasserstoff oder als Edelgase unten:

Indem diese elektromagnetische Strahlung (Licht) durch ein Prisma geleitet wird, werden die Emissionsspektren jedes dieser Elemente erhalten.
Früher dachte man, das erreichte Sonnenspektrum sei völlig kontinuierlich, aber der englische Wissenschaftler William Hyde Wollaston fand dies heraus Wenn man mit einem sehr schmalen Lichtstrahl arbeitete, mit einem Spalt von etwa 0,01 mm, konnte man sehen, dass das Sonnenspektrum sieben schwarze Linien enthielt darüber. Später die jungen Joseph Fraunhofer (1787-1826) fanden unter Verwendung von Prismen und Beugungsgittern heraus, dass das Sonnenspektrum tatsächlich Tausende von überlagerten schwarzen Linien enthält.
Einige Zeit später die körperliche Gustav Robert Kirchhoff er bemerkte, dass sich die gelben Flecken, die durch das Natriumspektrum erzielt wurden, genau an derselben Stelle befanden wie zwei schwarze Linien im Spektrum der Sonne. er und der chemiker Robert Wilhelm Bunsen führte mehrere Experimente durch und stellte fest, dass, wenn weißes Licht vom Bunsenbrenner, wie Sonnenlicht, durch das von Natrium emittierte gelbe Licht hindurchging und das Prisma gekreuzt wurde, um das Spektrum zu erzeugen; Das Ergebnis wäre ein kontinuierliches Sonnenspektrum in Regenbogenfarben, aber mit den schwarzen Linien (von Fraunhofer als D-Linien bezeichnet) an der gleichen Position wie die gelben Linien im Natriumspektrum.
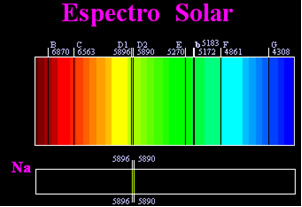
Die Sonne emittiert Licht in allen Farben, von Rot bis Violett, aber beim Durchgang durch die Erdatmosphäre absorbieren die vorhandenen Gase das Sonnenlicht genau in den Farben, die sie aussenden.
Diese Arten von Spektren heißen Absorptionsspektren.
Basierend auf diesen Beobachtungen, Kirchoff erstellt drei Gesetze für Spektroskopie, das sind:
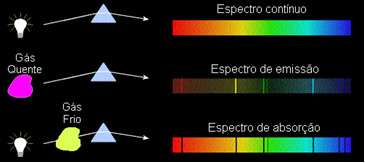
1) Ein Körper undurchsichtig heiß, in jedem der drei physikalischen Zustände, emittiert ein Spektrum kontinuierlich.
2) Ein Gas transparent – wie bei den oben gesehenen Edelgasen – erzeugt a Emissionsspektrum, mit dem Aussehen von Linien hell. Die Anzahl und Position dieser Linien wird durch die im Gas vorhandenen chemischen Elemente bestimmt.
3) Wenn a kontinuierliches Spektrum durchläuft ein Gas bei der niedrigsten Temperatur verursacht das kalte Gas die Anwesenheit von dunkle Linien, das ist ein Absorptionsspektrum. Dies geschah mit dem Spektrum des Sonnenlichts, das durch das Natriumgas hindurchtritt. Dabei hängen Anzahl und Lage der Linien im Absorptionsspektrum auch von den im Gas vorhandenen chemischen Elementen ab.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm
