Syrer er stoffer, der ioniseres i vandigt medium og er gode ledere strøm. Stoffets surhed kan måles ved hjælp af teknikker til måling af det hydrogenioniske potentiale (pH) af en løsning. Nogle pH-analysemetoder bruger indikatorer som lakmus eller phenolphthalein, som afspejler pH-værdien af opløsningen i farve.
Syrer kan karakteriseres:
ved tilstedeværelse eller ej af ilt i dets molekyle;
med magt;
ved ioniserbare hydrogener;
ved sin volatilitet.
Læs også:Sammenligning mellem syrer og baser - forskelle og egenskaber
Karakteristik af syrer
De ioniserer i et vandigt medium og frigiver H-kationen+.
De er ledere af elektricitet på grund af frigivelsen af ioner i et vandigt medium.
I kontakt med grundlæggende miljø lider de neutraliseringsreaktion, der danner salt og vand som produkter ved denne reaktion.
De ændrer opløsningens farve i nærværelse af et indikatorstof som lakmus eller phenolphthalein.
Den sure smag af citron, appelsin, blandt andre citrusfrugter, skyldes syren i disse fødevarer.
Brintpotentiale (pH)
Hydrogenionpotentialet (pH) er en beregning, der udtrykker ionkoncentration af hydrogen i en bestemt opløsning. For at bestemme pH og analysere mediet tages følgende i betragtning:
Ostwalds lov om fortynding (jo mere fortyndet, jo flere ioner dannes i opløsningen);
vand autoionisering (Kw), som er den naturlige nedbrydning af H-molekylet2O i H-ioner+ og åh-;
destilleret vand ved 25 ° C har autoionisering Kw = 10-14 og samme koncentration af H-ioner+ og åh-det vil sige, det er et neutralt medium.
Til pH-beregning, der involverer H-koncentration+, brug: pH = -log [H+].
Ved det:
pH> 7 → basisk opløsning
pH <7 → sur opløsning
pH = 7 eller pH = pOH → neutral opløsning
Se også: Hvordan er syreformler?

Klassificering af syrer
DET syreklassificering kan gøres under hensyntagen til fire forskellige kriterier.
Grad af ionisering (α) eller syrestyrke
α = antal ioniserede molekyler
antal opløste molekyler
Stærke syrer: α ≥ 50%.
Eksempel: ásyre svovlsyre (H2KUN4) → α = 61%.Halvstærke eller moderate syrer: 5% < α < 50%.
Eksempel: fosforsyre (H3STØV4) → α = 27%.Svage syrer: α ≤ 5%.
Eksempel: borsyre (H3BO3) → α = 0,075%.
→ Antal ioniserbart hydrogen
monosyre: frigiver et H-kation+.
Eksempel: ásyre saltsyre (HCL);
syre: frigiver to H-kationer+.
Eksempel: hydrogensulfid (H2S).Triacid: frigiver tre H-kationer+.
Eksempel: borsyre (H3BO3).tetracid: frigiver fire H-kationer+.
Eksempel: pyrophosphorsyre (H4P2O7).
Opmærksomhed! I tilfælde af hydracider er alle hydrogenerne i molekylet ioniserbare; men i tilfælde af oxysyrer er kun hydrogener, der er bundet til et oxygenatom, ioniserbare. Et eksempel er hypophosphorsyre (H3STØV2), som er en monosyre, fordi den til trods for at have tre hydrogener i dens sammensætning kun frigiver det hydrogen, der er bundet til ilt.
→ Tilstedeværelse af ilt
oxysyrer: har ilt i deres struktur.
Eksempel: hypochlorsyre (HOCl).
Hidracids: har ikke ilt i deres struktur.
Eksempel: flussyre (HF).
→ Volatilitet
Fast: kogepunkt(FOD) > 100 ° C, skifter langsomt til gasform.
Eksempel: svovlsyre (H2KUN4) → PE = 340 ° C.flygtige stoffer: kogepunkt <100 ° C, skifter hurtigt og let til gasform.
Eksempel: hydrogensulfid (H2S) → PE = -59,6 ° C.
Syrenomenklatur
→ Hidracids
Syre + anionnavn + hydric
For alle syrer bruges udtrykket "syre" før den nomenklatur, der karakteriserer molekylet. I hydrocider erstattes suffikset "eto" af elementets navn med "hydric".
Eksempler:
HCI → syre klorhydric
HBr → syre bromhydric
HF → syre fluorhydric
→ oxysyrer
Nomenklaturen for oxysyrer varierer alt efter oxidationsnummer (NOX) af det centrale element. Se nedenstående tabel:
NOX af centralt element |
Syrenomenklatur |
||
præfiks- |
-infiks- |
-suffix |
|
+1 og +2 |
Flodhest- |
-anion navn- |
-oso |
+3 og +4 |
-- |
Anion navn- |
-oso |
+5 og +6 |
-- |
Anion navn- |
-ic |
+7 |
Om |
-anion navn- |
-ic |
Eksempler:
HC1 → At vide, at brint (H) normalt har NOX +1 og ilt (O) har NOX -2, for at vi skal have et 0 ladningsmolekyle, skal chlor (Cl) have NOX +1, så nomenklaturen for denne syre er hypochlorsyre.
HNO2 → salpetersyre
HC14 →ásyresaltsyre
→ Undtagelser fra reglen
H2CO3 → kulsyre, og ikke kulstofholdigt, som det ville være under NOX-reglen.
H3BO3 → ásyre boric, og ikke kedelig.
Syrer i hverdagen
Gødning og medicin: Phosphorsyre (H3STØV4) er meget brugt til fremstilling af gødning og også som medicin. Det er en af flere syrer, der anvendes inden for det farmaceutiske område.
Citrusfrugter: har ascorbinsyre (C6H8O6), også kendt som C-vitamin.
Eddike: har i sin sammensætning Eddikesyre (CH3COOH).
- Mousserende vand og læskedrikke: sammensat af kulsyre (H2CO3), som giver produktet en forfriskende fornemmelse.
Også adgang:Syres rolle i læskedrikke

løste øvelser
Spørgsmål 1 - (Enem) Saften ekstraheret fra rødkål kan bruges som en indikator for syrekarakteren (pH mellem 0 og 7) eller basisk (pH mellem 7 og 14) i forskellige opløsninger. Ved at blande lidt kåljuice og opløsningen begynder blandingen at vise forskellige farver alt efter dens sure eller basiske karakter i henhold til nedenstående skala.
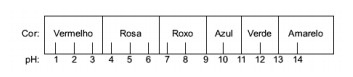
Nogle løsninger blev testet med denne indikator, hvilket gav følgende resultater:
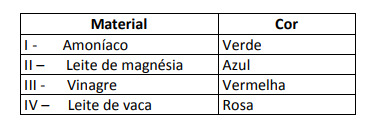
Ifølge disse resultater har opløsning I, II, III og IV henholdsvis følgende karakter:
A) sur / basisk / basisk / sur.
B) syre / basisk / syre / basisk.
C) basisk / sur / basisk / sur.
D) syre / syre / basisk / basisk.
E) Grundlæggende / grundlæggende / syre / syre.
Løsning
Alternativ E. For at bestemme, om stoffet har en sur, basisk eller endog neutral karakter, foretages en analyse af farverne opnået i testen i forhold til dataene i den givne skala. Når vi ved, at opløsninger med pH = 7 er neutrale, pH> 7 er basiske og med pH <7 er sure, når vi frem til konklusion om, at ammoniak og mælk af magnesia er basiske stoffer, og eddike og komælk er syrer.
Spørgsmål 2 - (PUC-Camp) Med hensyn til stofferne kaldet syrer bemærkede en studerende følgende egenskaber:
Jeg - har ætsende kraft;
II - er i stand til at neutralisere baser;
III - består af to kemiske grundstoffer;
IV - danner vandige opløsninger, der leder elektrisk strøm.
Han lavede KUN fejl i
A) I og II
B) I og III
C) I og IV
D) II og III
E) III og IV
Løsning
Alternativ B. Ikke alle syrer er ætsende, kun de stærkeste, og syrer kan bestå af to eller flere atomer.
af Laysa Bernardes
Kemilærer


