DET vinkelgeometri er en af flere typer molekylær geometri, som stadig kan være lineær, pyramideformet, flad trigonal, tetraeder, etc. Vinkelgeometri kan kun findes i molekyler, der har følgende egenskaber:
Triatomics, det vil sige, de har kun tre atomer;
Har mindst tre elektronskyer i det centrale atom.
Bemærk: elektronisk sky er alt kovalent binding (enkelt, dobbelt, tredobbelt eller koordinat) mellem atomer og elektronpar af valenslag som ikke deltager i et opkald.
Se nogle eksempler på molekyler, der har vinkelgeometri:
1. eksempel: vand (H2O)

konventionel vandstruktur
I vandets struktur har vi:
Tre atomer: to hydrogener og et ilt;
Oxygen er det centrale atom, fordi det danner et større antal bindinger (to, da det hører til VIA-familien);
To enkeltbindinger mellem ilt og hydrogen. Dette skyldes, at hvert brint kun kan danne en binding og ilt to bindinger;
Fire ikke-bindende elektroner i ilt, da den har seks elektroner i valensskallen og kun bruger to i bindingerne.
Som i vandmolekylet er der derfor tre atomer og fire elektroniske skyer (to enkeltbindinger og to ikke-bindende elektronpar) i det centrale atom,
geometri er vinklet.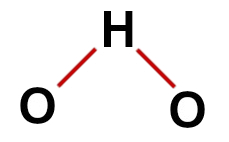
Korrekt strukturformel for vand
Bemærk: Når molekylet præsenterer disse mønstre, er vinklen dannet mellem atomerne ca. 109º 28'.
2. eksempel: Svovldioxid (SO2)

Konventionel struktur af svovldioxid
I strukturen af svovldioxid har vi:
Tre atomer: to oxygener og et svovlatom;
Svovl er det centrale atom, da det er det mindste element i molekylet, da alle grundstoffer har brug for at danne det samme antal bindinger (to);
En dobbeltbinding mellem svovl og en af oxygener. Det er fordi begge har brug for to forbindelser;
En koordinat eller dativ kovalent binding, fordi svovlet var stabilt efter parring med det andet ilt, men der er stadig et iltatom, der har brug for to elektroner;
Fire ikke-bindende elektroner i ilt. Dette skyldes, at ilt har seks elektroner i valensskallen og kun bruger to i bindingene.
Som i svovldioxidmolekylet er der således tre atomer og fire elektroniske skyer (to enkeltbindinger og to par ikke-bindende elektroner) i det centrale atom, geometri er vinklet.
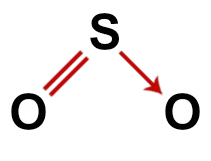
Korrekt strukturformel for svovldioxid
Bemærk: Når molekylet har disse mønstre, er vinklen dannet mellem atomerne ca. 120O.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm