DET salthydrolyse mellem stærke syrer og baser det opstår, når kationen i et salt ikke interagerer med anionen i vand, og anionen i saltet ikke interagerer med kationen i vand. Hydrolyse mellem kationer og anioner af et salt og vand forekommer kun, når det dannede produkt er en svag syre, en svag base eller begge dele. Forstå salthydrolysen mellem stærke syrer og stærke baser trin for trin:
a) Trin 1: vandionisering
Vand er et stof, der har evnen til at lide autoioniseringdet vil sige, det producerer hydroniumkation (H+) og hydroxidanion (OH-) fra dens struktur.
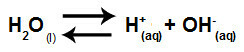
Ligning, der repræsenterer selvionisering af vand
b) Trin 2: Dissociation salt
Når et salt tilsættes vand, går det gennem dissociationsprocessen. Da salt er en ionisk forbindelse, frigives dets kationer og anioner i vand i mediet som i ligningen vist nedenfor:
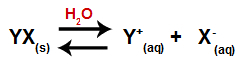
Ligning, der repræsenterer dissociationen af ethvert salt
Trin 3: Salthydrolyse af stærke syrer og baser
Til stærk syre: når anionen af saltet kombineret med H+ vand til dannelse af HCl, HBr, HI eller en anden syre, hvor subtraktionen af antallet af oxygener med antallet af hydrogener er lig med eller større end 2, vil vi have en
stærk syre. Derfor forekommer kombinationen mellem de nævnte ioner ikke.For et stærkt fundament: når kationen af saltet, der hører til IA (alkalimetaller) eller IIA (jordalkalimetaller bortset fra magnesium), kombineres med OH- vand, vil det danne en stærkt fundament. Derfor forekommer kombinationen mellem de nævnte ioner ikke.
Når saltioner ikke interagerer med vandioner, har vi følgende ligning:
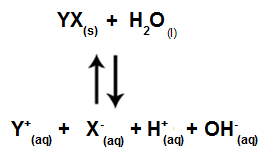
Ligning, der viser alle ioner, der er til stede i opløsningen
Sammenfattende, da saltionerne ikke interagerer med vandionerne, fremmer saltionerne ikke nogen ændring i den endelige opløsning. Således kan vi skrive ligningen af en salthydrolyse mellem stærke syrer og stærke baser bare med vandioniseringsligningen.
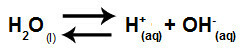
Ligning, der repræsenterer hydrolyse af stærke syrer og baser
d) Eksempel på salthydrolyse mellem stærke syrer og baser
Når vi tilsætter kaliumchloratsaltet til vand (KClO3salt adskilles og frigiver kaliumkationen (K+og chloratanionen (ClO3-) i midten.
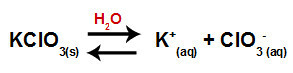
Dissociationsligning for kaliumchlorat
Det er vigtigt at huske, at vand gennemgår selvionisering og forsyner mediet med hydroniumkation (H+) og hydroxidanion (OH-). Vi skal nu vurdere samspillet mellem salt og vandioner.
Når H+ interagerer med ClO3-, det danner perchlorsyre (HclO3). Da subtraktionen af antallet af oxygener med antallet af ioniserbare hydrogener i perchlorsyre er 2, er den stærk. Derfor forekommer interaktionen mellem ionerne ikke.
Når K-kationen+ interagerer med OH-anionen-, har vi dannelsen af en stærk base, da kalium er et alkalimetal. Derfor forekommer interaktionen mellem ionerne ikke.
Ligningen, der repræsenterer salthydrolysen mellem stærke syrer og baser fra opløsning af kaliumchlorat i vand er:
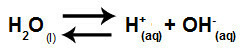
Kemisk ligning af kaliumchlorathydrolyse
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm

