Grundlag er uorganisk stof som ifølge den svenske kemiker Svante Arrhenius, når den placeres i vand, lider fænomenet ionisk dissociation, hvor der er frigivelse af ioner: kation (Y+) og hydroxidanion (OH-).

Generel formel for en Arrhenius-base
Y-gruppen af a grundlag det kan være ethvert metal eller ellers fra ammoniumgruppen (NH4+), som frigives i vand som kationer under dissociation, som det kan ses i ligningen, der repræsenterer processen:
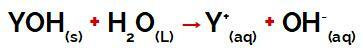
Ligning, der repræsenterer dissociationen af en base
Se nedenfor nogle meget vigtige oplysninger om klassificering og nomenklatur for baser.
1) Klassifikation vedrørende basernes opløselighed(evne til at at opløse i vandet)
Baser opløselig: har alkalimetal eller ammonium i sammensætningen;
Baser sparsomt opløseligt: har jordalkalimetal i sammensætning. Eksempel: magnesiumhydroxid, bredt anvendt som et antacida og afføringsmiddel;
baser praktisk talt uopløselig: har noget andet metal i sammensætningen. Eksempel: aluminiumhydroxid, meget anvendt som et antacida.
2) Klassifikation vedrørende græsrodsstyrke(evne til at tage afstand i vandet)
Baser stærk: har alkali- eller jordalkalimetaller, med undtagelse af magnesium, i sammensætningen;
Baser svag: har noget andet metal i sammensætningen.
3) Basisnomenklatur
For at navngive en base skal du blot følge navngivningsreglen nedenfor:
Hydroxid + de + navn på metal eller ammonium
Eksempel: Ca (OH)2 → calciumhydroxid
Hvis basen har et kemisk element, der ikke hører til IA-, IIA- eller IIIA-familierne (og det er ikke sølv eller zink), skal vi angive nummeret for elementets navn i romertal hydroxyler:
Eksempel: Ti (OH)4 → titaniumhydroxid IV
Af mig. Diogo Lopes
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm