Hybridisering er navnet på fusionen eller foreningen af ufuldstændige atomorbitaler, et fænomen, der øger antallet af kovalente bindinger at et atom kan gøre. Husk at orbital er det område af atomet, hvor der er større sandsynlighed for at finde en elektron.
At kende antallet af bindinger, et atom skaber og forstå fænomenet hybridisering, er det nødvendigt at kende nogle grundlæggende punkter om atomet:
1O punkt: energiniveauet
Energiunderværdierne, som et atom kan have, er s, p, d, f.
2O punkt: antal orbitaler pr. underniveau
Hvert energiniveau har forskellige mængder orbitaler, som vi kan se nedenfor:
Underniveau s: 1 orbital;
p underniveau: 3 orbitaler;
Underniveau d: 5 orbitaler.
Den generiske repræsentation af disse orbitaler udføres som følger:
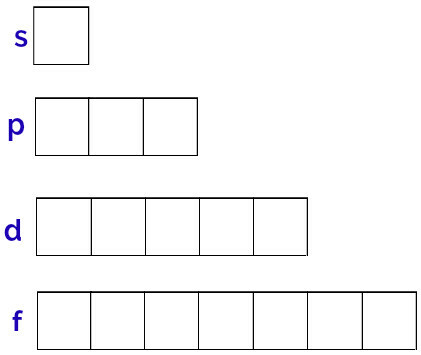
Repræsentation af hvert subniveaus orbitaler
Ifølge Pauli kan et orbital maksimalt have 2 elektroner med drejer (roterende bevægelser) modsat.
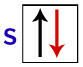
Repræsentation af s orbital med dets elektroner
Ifølge Hund modtager en orbital i et underniveau kun sin anden elektron, når alle de andre orbitaler i det underniveau allerede har modtaget den første elektron.
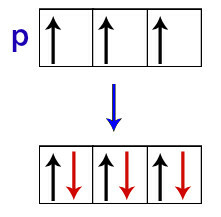
Fordeling af elektroner i p-underniveau orbitaler
3O punkt: elektronisk distribution
For at forstå hybridisering og antallet af bindinger, som et atom danner, er det vigtigt at udføre elektronisk fordeling på Linus Pauling-diagrammet.

Linus Pauling-diagram
Husk at det maksimale antal elektroner i hvert underniveau er:
s = 2 elektroner;
p = 6 elektroner;
d = 10 elektroner;
f = 14 elektroner.
Efter denne korte gennemgang kan vi definere nu hvad er hybridisering?. Til dette vil vi bruge det kemiske element bor (Atom nummer = 5) som et eksempel.
Når vi udfører elektronisk borfordeling, har vi:
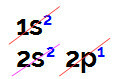
Elektronisk borfordeling i Linus Pauling-diagrammet
Det er muligt at observere i denne fordeling, at bor har 2 elektroner i s underniveau og 1 elektron i p underniveau af valenslag.
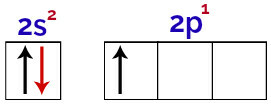
Elektroner i borvalenslagets orbitaler
Da bor har 1 ufuldstændig orbital, bør den derfor kun lave en kovalent binding, da antallet af obligationer altid er direkte relateret til antallet af ufuldstændige orbitaler.
Når boratomet modtager energi fra det ydre miljø, bliver dets elektroner, især dem i valensskallen, begejstrede. Dette får en af elektronerne fra s orbital til at forlade og optage en af de tomme p orbitaler, hvilket resulterer i 3 ufuldstændige atomorbitaler, som du kan se på følgende billede:

Repræsentation af boratomets ophidsede tilstand
Endelig er der foreningen af den ufuldstændige orbital med de ufuldstændige p-orbitaler. Denne union kaldes hybridisering. Da vi har sammensmeltningen af en s orbital med to p, kaldes det hybridisering sp2.
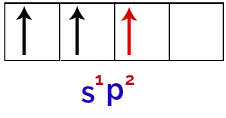
Repræsentation af hybridiserede orbitaler i boratomet
Ud over bor gennemgår adskillige andre kemiske grundstoffer fænomenet hybridisering, såsom svovl (S), Xenon (Xe), fosfor (P), kulstof (Ç), beryllium (Være).
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm

