Energioxidation i alkyner er en organisk reaktion, der opstår, når en alkyn (et carbonhydrid, der har en tredobbelt binding mellem to carbonatomer) tilsættes til en sur opløsning med reagens fra baeyer (Kaliumpermanganat - KMnO4).
BEMÆRK: En reaktion af energioxidation kan udføres med kaliumdichromat (K2Cr2O7), og ikke kun kaliumpermanganat.
Hver gang en reaktion fra energisk oxidation i alkyner udføres, de produkter, der kan stamme, er carboxylsyrer, vand (det eneste element, der vises i nogen af dem) og kuldioxid (CO2).
Baeyer-reagens i surt medium
Når Baeyers reagens blandes med vand, i nærvær af en syre (stof, der er i stand til at frigive H-ioner+), dannelsen af to oxider (kaliumoxid og manganoxid II) og spirende oxygener ([O]).

Mekanismer til energioxidation i alkyner
1. mekanisme: bryde den tredobbelte bånd.
Oprindeligt angribes den tredobbelte binding af spirende oxygener dannet af Baeyers reagens. Dette angreb får den tredobbelte binding til at blive helt brudt.
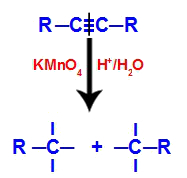
Forstyrrelse af den tredobbelte binding ved angreb af voksende oxygener
Når den tredobbelte binding brydes, opdeles alkynen i to dele. På hvert af kulstofferne, der var tredobbeltbinding, vises tre frie valenser.
2. mekanisme: Interaktion mellem hydroxylgrupper
Hver af de frie valenser på carbonerne, hvor den tredobbelte binding var optaget af hydroxylgrupper (OH), der dannede en polyol (alkohol med flere hydroxyler).
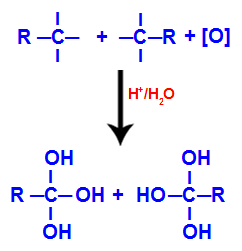
Dannelse af polyol med hydroxylgrupper efter tredobbelt spaltning
BEMÆRK: Hvis carbonet, hvor den tredobbelte binding plejede at være, har et hydrogenatom bundet til det, modtager dette hydrogenatom et spirende ilt og danner også et andet hydroxyl.
3. mekanisme: Dannelse af vandmolekyler
Når et kulstof har to eller flere OH-grupper, bliver det en meget ustabil struktur på grund af tilstedeværelsen af ekstremt elektronegativer. På grund af ustabilitet undergår molekylet selvudtørring, det vil sige en hydroxyl binder til hydronium (H+fra en anden hydroxyl og danner vand.

Dannelse af vandmolekyler fra to hydroxyler til stede i den dannede polyol
4. mekanisme: Produktdannelse
Efter dannelsen af vandmolekyler mister kulstof en binding på grund af udgangen af a hydroxyl, og iltet fra den anden hydroxyl mister også en binding, der blev lavet med en hydrogen. Derfor, mellem dette kulstof og ilt, vises en dobbeltbinding, der danner en carbonyl (C = O) og stabiliserer begge.
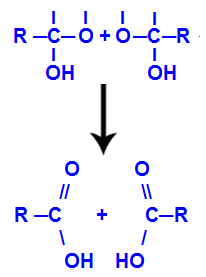
Carbonyldannelse i de to strukturer opnået fra alkyn
Eksempel på en Alkyne energioxidationsligning
Eksempel: Energisk oxidation af But-1-ino
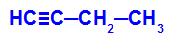
Strukturformel for but-1-yne
Når but-1-yne placeres i et medium indeholdende Bayers reagens, vand og syre, brydes bindingen. tredobbelt eksisterende mellem kulstof 1 og 2 på grund af angrebet af de voksende oxygener, der findes i midten, som i ligningen bælge:
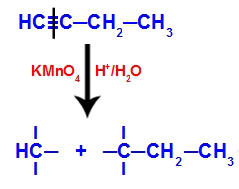
Brud på but-1-yne forbindelserne
Når den tredobbelte binding er brudt, modtager kulstof 1 og 2 tre hydroxyler, men kulstof 1 vil have en mere, fordi det havde et hydrogenatom (som binder til et spirende ilt) og danner to polyoler (fragment 1 og 2).

Ligning, der repræsenterer dannelsen af polyoler
Kort efter, da polyoler er ustabile, har vi dannelsen af vandmolekyler fra hydroxylerne. I fragment 1 vises et vandmolekyle (fordi der er tre hydroxyler), og i fragment 2 vises to molekyler (fordi der er fire hydroxyler).
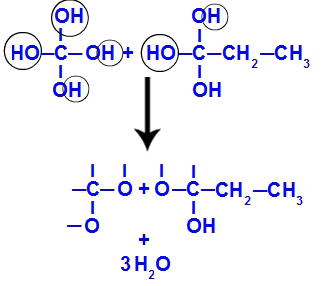
Dannelse af vandmolekyler fra but-1-yne fragmenter
Endelig har vi dannelsen af dobbeltbindingen mellem carbonatomer, der har mistet hydroxyl og oxygener, der har mistet hydrogen, hvilket giver anledning til carbonyler.

Dannelse af carbonyler i but-1-yne fragmenter
Med ligningen ovenfor kan vi se, at but-1-yne gav anledning til en carboxylsyre og kuldioxid (CO2).
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm


