En tilføjelsesreaktion er en kemisk proces, hvor atomer af et uorganisk stof sættes til et organisk molekyle, som skal have en af følgende egenskaber:
Åben struktur indeholdende binding eller pi links;
Mættet lukket struktur (kun med sigma links);
Lukket umættet struktur (med en pi eller aromatisk binding).
De organiske forbindelser, der har disse egenskaber, er som følger Kulbrinter:
alkener;
Alkynes;
Alkadienes;
Cyklaner;
Cykler;
Aromater.
Under en tilføjelsesreaktion, er en eller flere pi-obligationer eller en sigma-binding (i det eksklusive tilfælde af en cyclan) brudt forårsager, at to eller flere frie valenser (bindingssteder) vises på de involverede carbonatomer, som i eksemplet bælge:
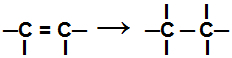
Bryde pi-bindingen i en alken
Efter at denne binding er brudt, skal tilsætningen af atomer ske på de nye bindingssteder oprettet i den organiske forbindelse. Vi viser nedenstående typer af tilføjelsesreaktioner der kan udføres med organiske forbindelser.
hydrogenering
Heri tilføjelsesreaktionudover den organiske forbindelse er den anden reaktant hydrogengas (H
2). I hvert af kulstofferne, hvor spaltningen opstår (brud på sigma- eller pi-bindingen, som set før), vil der være bindingen af et hydrogenatom, der henviser til mængden af brudte bindinger.Når vi f.eks. Udfører hydrogeneringen af cyclobutan, brydes en sigmabinding mellem kulstof 1 og 2. Derefter binder et hydrogenatom sig til hvert af disse kulstoffer:
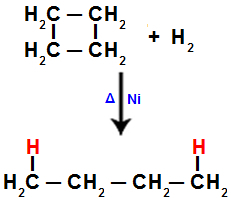
Ligning, der repræsenterer hydrogenering i cyclobutan
Halogenering
Ud over den organiske forbindelse er det andet reagens i dette tilføjelsesreaktion er et molekylært halogen (chlor-Cl-gas2, fluor-F-gas2, fast iod-I2 og flydende brom-Br2). Ved hvert kulstof, hvor fission opstår (at bryde sigma- eller pi-bindingen, som vist ovenfor), vil der være bindingen af et atom af halogen med henvisning til antallet af ødelagte forbindelser.
Når vi således udfører halogeneringen (ved hjælp af chlorgas) af cyclopropen, brydes pi-bindingen mellem carbon 1 og 2. Derefter binder et kloratom til hvert af disse kulstoffer:

Ligning, der repræsenterer halogenering i cyclopropen
Tilsætningsreaktion med halhydrider
Et halogenid er en uorganisk hydra syre, dannet af et hydrogenatom og et hydrogenatom. halogen, såsom saltsyre (HCI), flussyre (HF), brombrintesyre (HBr), syre hydroiodisk (HI).
På tilføjelsesreaktion med halogenid er det andet reagens ud over den organiske forbindelse et halogenid, deraf et af kulstofferne, hvor spaltning (brud på sigma- eller pi-bindingen, som vist ovenfor), skal modtage hydrogenatomet, og den anden modtager halogenid.
Ifølge Markovnikovs styre, skal det mest hydrogenerede carbonatom (eller det carbon, der er bundet til en mindre radikal) modtage hydrogen, og det mindre hydrogenerede carbon (eller det carbon, der er bundet til en større gruppe), skal modtage halogenid.
For eksempel, når vi udfører denne reaktion på propen med saltsyre (HCI), brydes pi-bindingen mellem carbon 1 og 2. Derefter binder hydrogen til carbon 1 (mere hydrogeneret) og chlor til carbon 2 (mindre hydrogeneret):
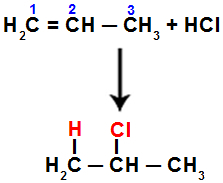
Ligning, der repræsenterer tilsætningen med halogenid i propen
Hydreringsreaktion
Vandmolekylet, når det ioniserer, producerer hydroniumkationen (H+og hydroxidanionen (OH-). Af den grund i dette tilføjelsesreaktionud over den organiske forbindelse er den anden reaktant vand. Således modtager et af kulstofferne, hvor spaltningen opstår (brud på sigma- eller pi-bindingen, som vist ovenfor), hydroniumkationen, og den anden modtager hydroxidanionen.
I henhold til Markovnikovs regel er det mest hydrogenerede carbonatom (eller carbonet bundet til en mindre radikal) skal modtage hydronium, og det mindre hydrogenerede kulstof (eller det kulstof, der er bundet til en større gruppe) skal modtage hydroxid.
Når vi fx hydrerer penta-1,4-dien, brydes pi-bindingen mellem carbon 1 og 2 og mellem carbon 4 og 5. Derefter modtager carbon 1 og 5 hydronium, og carbon 2 og 4 modtager hydroxidet:
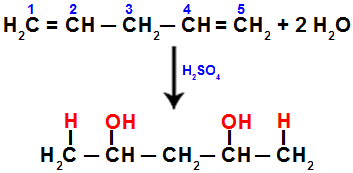
Ligning, der repræsenterer tilsætning med hydrering i penta-1.4 dien
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm
