Du sæber og rengøringsmidler bruges til at fjerne snavs og især fedt fra materialer. Men hvad er forskellen mellem de to? Er der mere fordel ved at bruge sæbe eller vaskemiddel? Hvad med miljøet? Hvilket forurener mindre?
Lad os se på strukturen for hver enkelt for at nå frem til et tilfredsstillende svar.
Sæber har følgende typiske struktur:
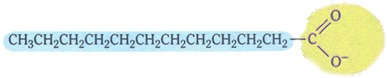
Typisk struktur af sæber.
Bemærk, at den har en ikke-polær del, repræsenteret af farven blå, som interagerer med fedt og olie, som også er upolær; og har en polær del (i gul), som interagerer med vand.
Strukturen af vaskemidler har også en polær og en ikke-polær del, som det kan ses nedenfor:
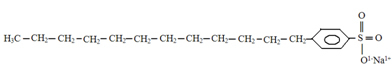
Typisk struktur for vaskemidler.
Det punkt, vi vil henlede opmærksomheden på, og som kan observeres ved at sammenligne de to strukturer, er at de mest almindelige vaskemidler er salte afledt af svovlsyre (H2KUN4), som er en stærk syre og medfører mere skade på miljøet. Derfor er der tilstedeværelsen af svovl (S) i vaskemiddelstrukturen. Det grundlæggende råmateriale til vaskemidler er Olie, som er en ikke-vedvarende fossil energiressource.
Desuden er ovenstående tilfælde et biologisk nedbrydeligt vaskemiddel, men der er nogle vaskemidler, som er dem, der har forgreninger i deres struktur, som ikke er biologisk nedbrydelige, eller det vil sige, de nedbrydes ikke af mikroorganismer, og hvis de dumpes i floder og søer, kan det forårsage alvorlige miljøvirkninger med den deraf følgende død af forskellige fisk, alger, insekter og fugle vandmiljø.
Sæber er lavet af olier eller fedtstoffer, der reagerer med en stærk base, såsom natriumhydroxid (NaOH). Så sæber er carboxylsyresalte, som er svage syrer. I strukturen af disse sæber erstattes carboxylgruppens brint (─COOH) med natriumioner (Na+), kalium (K+) eller ammonium (NH4+), som vist nedenfor. Resultatet er, at alle sæber er biologisk nedbrydelige.
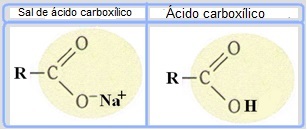
Sæber er salte af carboxylsyrer, hvor hydrogenet i syren erstattes af et kation.
En anden ulempe ved vaskemidler er, at mange af dem indeholder fosfationer i sin struktur. Disse ioner bruges af alger som næringsstoffer, så når disse rengøringsmidler dumpes i floder er deres fosfationer steget drastisk, og disse alger formere sig i stort antal. vægt. Denne proces kaldes eutrofiering og forårsager fisk og andre vandlevende væsenes død, da algerne dækker overfladerne på søer og forhindrer indtrængen af lys og ilt i vandet.
Dermed, hvis vi ser på miljøproblemet, er barsæbe den bedste løsning.

Overdreven algblomstring kaldes eutrofiering.
Men hvad med effektivitet?
Nå, sæber har en ulempe, når rengøringen sker med vand, der indeholder calcium, magnesium og jernkationer, som anionerne i sæber kan reagere med disse kationer med oprindelse i uopløselige forbindelser, som udfælder og danner det såkaldte vand hårdt. Som følge heraf kan sæber ikke fjerne snavs og fedt.
Rengøringsmidler har derimod den fordel i forhold til sæber, at de aldrig reagerer med kationerne i hårdt vand og derfor renser uanset det anvendte vand.
Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/sabao-x-detergente.htm


