DETosmose og opløsningsmiddelpassage fra en mindre koncentreret opløsning til en mere koncentreret opløsning gennem en semipermeabel membranindtil det tryk, der udøves af opløsningen på membranen, forhindrer passage af opløsningsmiddel. Denne proces er beregnet til afbalancere koncentrationen af opløsningen.
Læs også: Opløs og opløsningsmiddel
osmotisk tryk
DET osmotisk tryk og tryk udøvet på opløsningen med større koncentration således at osmose ikke forekommer, dvs. således at opløsningsmidlet ikke krydser den semipermeable membran.
Osmotisk tryk anvendes i processer af afsaltning af vand, tvinger processen med omvendt osmose, hvilket får opløsningsmidlet til at passere fra den mere koncentrerede opløsning til den mindre koncentrerede. Vi kalder denne proces omvendt osmose. Se følgende billede, der sammenligner de to processer:
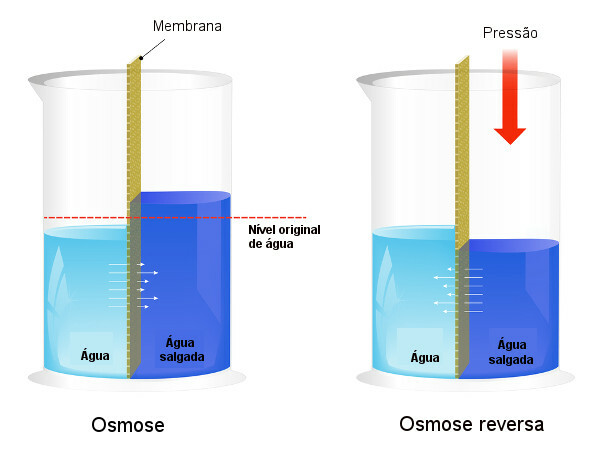
Bemærk, at i osmose er passage af opløsningsmiddel i retning af den mest koncentrerede opløsning, og at i omvendt osmose er passagen i den modsatte retning på grund af det påførte tryk. For at lære mere om emnet, læs vores tekst:
osmotisk tryk.vide mere: Omvendt osmose i afsaltning af havvand
osmotisk trykligning
Osmotisk tryk, repræsenteret af brevet pi (π) af en opløsning, kan beregnes ved hjælp af følgende ligning:
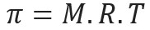
M = koncentration i mol / l
R = universel konstant af perfekte gasser
T = absolut temperatur i K
som andre kolligative egenskaber, afhænger det osmotiske tryk af opløsningskoncentrationjo større koncentration af opløsningen er, jo større er effekten af osmose på opløsningerne og derfor jo større er det osmotiske tryk.
Eksempler
Osmose vises i vores daglige liv på forskellige tidspunkter. Vi kan nævne eksemplet på kødsaltningsproces til din bevarelse. Du mikroorganismer der ville medføre nedbrydning af kød mister vandindefra og udefra, som har en koncentration af salt, hvilket får maden til at vare længere.
På grund af saltet sker det også, at salatblade visner for at miste vand indefra celler (slags mindre koncentreret) til hærdet løsning i det eksterne miljø.
Osmose er også vigtigt, når vi taler om blod human. Vi siger, at Røde celler og blodet er et isotonisk medium, det vil sige, de har det samme osmotiske tryk, der let tillader ind- og udgang af vand fra cellen.
Når blodet imidlertid bliver mindre koncentreret end inde i de røde blodlegemer (hypotonisk medium), vil vandets passage lettere forekomme inde i cellen, hvilket gør det svulme indtil burst. Hvis blodet når en koncentration, der er større end koncentrationen af den røde blodlegeme (hypertonisk medium), blodlegemer visner, da de mister vand.

Efter det samme princip om konservering af kød, er frugtbevarelsei slikkompotterne, der opbevarer mad pga høj sukkerkoncentration i løsningen.
Følgende er andre eksempler, hvor osmose opstår:
- i stigningen af saft i anlæggets ledende skibe
- kl hæmodialyse;
- i selektiv passage af næringsstoffer i cellerne i menneskekroppen.
For at forstå, hvordan osmose sker i dyrecellen, plantecellen og andre biologiske problemer, skal du læse: Osmose: hvad det er, og hvordan det forekommer i dyre- og plantecellen.
Af Victor Ferreira
Kemi lærer


