DET stereoisomerisme, også kendt som Rumisomerisme, er en type isomerisme, hvor dens isomerer adskiller sig ved, at båndene mellem deres atomer arrangeres forskelligt i rummet.
Der er to typer stereoisomerer, diastereoisomerer og enantiomerer. Diastereoisomerer er geometriske isomerer af cis-trans typen, som ikke er spejlbilleder af hinanden, mens enantiomerer er optiske isomerer, der er spejlbilleder af hinanden.
Taler lidt om cis-trans diastereoisomer, forekommer det kun i forbindelser, der er umættede eller cykliske. Hvorfor forekommer det ikke i mættede kædeforbindelser, det vil sige, der kun har enkeltbindinger mellem carbonatomer?
Det kan ske, at vi bliver forvirrede og tænker, at visse mættede forbindelser er diastereoisomerer, når de faktisk repræsenterer den samme forbindelse. For eksempel nedenfor har vi tre rumlige konformationer af atomerne i 1,2-dichlorethan:
H H H H H Cl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Cl ClCl H Cl H
Er disse tre diastereoisomerer? Lade være med. Rent faktisk,
de tre molekyler har den samme forbindelse. Hvad der sker er, at enkeltbindinger eller sigma (σ) mellem carbonatomer kan gennemgå rotation, hvilket resulterer i forskellige atomarrangementer.Se hvordan dette sker i skemaet nedenfor med etan:

Disse forbindelser, som faktisk er den samme forbindelse, udfører ikke geometrisk cis-trans-isomerisme, men kaldes konformationelle isomerer, da de kun adskiller sig i konformationen af deres atomer forårsaget af rotation omkring enkeltbindingen.
En af måderne til at repræsentere disse molekyler for at gøre det let at visualisere rotation af forbindelsesaksen er gennem Newmans projektion, hvor det betragtes som om synsplanet var nøjagtigt på aksen for båndet mellem kulstofferne, og de er repræsenteret af en central cirkel. Se Newmans fremskrivning for etan:

Vi kan også repræsentere disse forskellige konformationer gennem formel på staffelier:
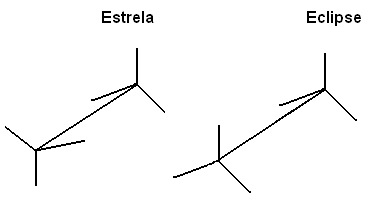
Denne frie rotation af koblingsaksen forekommer ikke længere i umættede forbindelser eller i cykliske. Forestil dig f.eks., At vi bygger en simpel model, der repræsenterer to kulstoffer af to isopor-kugler, der er forbundet med et tandstikker, der sidder fast i dem.
Når vi har et enkelt tandstikker, og vi holder en af kuglerne, kan den anden let dreje rundt om sin egen akse, ligesom det gør med simpel binding.

Men hvis vi placerer endnu et tandstikker, der forbinder de to kugler, vil vi ikke være i stand til at holde den ene kugle og rotere den anden. Hvis vi gør dette, vil tandstikkerne knække. Ligeledes, når der er en pi-binding og en sigma (dobbeltbinding), er der en hindring for rotation af kulstofferne.
Derfor er det i nedenstående tilfælde, hvor vi har en dobbeltbinding mellem kulstofferne, ikke et spørgsmål om to konformationsisomerer, det vil sige to konformationer for det samme molekyle; vi har faktisk to cis-trans diastereoisomerer:
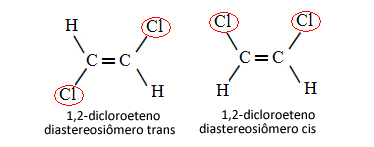
Se mere om denne type isomerisme i teksten Geometriske eller cis-trans-isomerer.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm
