Kapaciteten, som forbindelserne har til at tiltrække elektriske ladninger, defineres som polaritet, som får en anden karakter afhængigt af den forbindelse, hvor den er til stede.
De hyppigste bindinger, der involverer organiske forbindelser, forekommer mellem kulstofatomer eller mellem kulstof- og brintatomer: C - C og C - H (kulbrinter). Vi klassificerer denne type binding som kovalent, den er til stede i alle bindinger af organiske forbindelser, der kun er dannet af kulstof og brint.
Når der i molekylet af en organisk forbindelse er et andet kemisk element udover kulstof og brint, vil dets molekyler have en vis polaritet. Vi kalder dette element et heteroatom, og det kan være: nitrogen (N), oxygen (O), blandt andre.
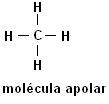
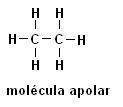
Metan (CH4Ethan (C2H6)
Bemærk, at der i begge strukturer ikke er nogen tilstedeværelse af heteroatomer, i dette tilfælde er molekylerne klassificeret som ikke-polære.


Tilstedeværelsen af ilt som heteroatom får molekylerne til at vise polaritet. Det første molekyle er forbindelsen Ethanol (
CH3CH2Åh), giver tilstedeværelsen af hydroxyl-OH denne forbindelse en polær karakter, selvom den i sin struktur indeholder en ikke-polær del.Af Líria Alves
Uddannet i kemi
Brazil School Team
Se mere! flad isomer
Organisk kemi - Kemi - Brasilien skole
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm


