På intermolekylære kræfter de er elektrostatiske tiltrækningskræfter, hvis funktion er at forene molekyler (molekylære forbindelser) og holde dem i fast eller flydende tilstand. De er ekstremt vigtige, da de bestemmer alle fysiske egenskaber (smeltepunkt, kogepunkt, densitet og opløselighed) af stoffer.
I denne tekst vil vi studere forholdet mellem intermolekylære kræfter og stoffernes kogepunkt. Lad os indledningsvis huske tre vigtige typer intermolekylære kræfter, som er:
♦ dipol dipol: er den kraft, der forekommer i polære molekyler. Da disse molekyler har en positiv og negativ pol, er dipol-dipolkraften baseret på tiltrækningen mellem den positive ende af et molekyle og den negative ende af et andet. Eksempler: HCI, HBr, SO2 og PH3
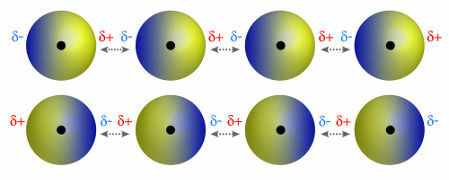
Molekyler, der har en positiv og negativ pol, der tiltrækker hinanden
♦ Induceret dipol: er den intermolekylære kraft, der kun forekommer i ikke-polære molekyler (de har ikke poler). Når to apolære molekyler nærmer sig, opstår der en kortvarig deformation af deres skyer elektroner, som forårsager en ubalance i molekylets elektroner, som fordeles i en anderledes for hende. I det øjeblik oprettes en kortvarig dipol, og molekylet har kortvarigt en positiv og negativ pol, som forårsager tiltrækningen. Eksempler: CO
2CH4 og BH3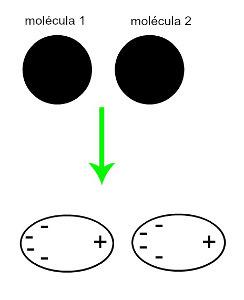
Tilgangen til to ikke-polære molekyler genererer en deformation og følgelig en omfordeling af elektroner, som danner de momentane dipoler
♦ Brintobligationer: det er den intermolekylære kraft, der forekommer i polære molekyler, men kun i dem, der obligatorisk har hydrogenatomer bundet direkte med fluor-, ilt- eller nitrogenatomer. Det kan betragtes som en dipol-dipolkraft, men med meget større intensitet. Interaktionen finder altid sted mellem brintet i et molekyle og det andet atom (F, O, N) i et andet molekyle. Eksempler: H2O, NH3 og HF
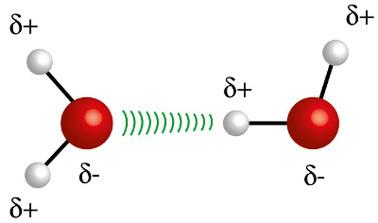
Hydrogenatomet (hvid kugle) i et molekyle interagerer med ilt (rød kugle) i et andet vandmolekyle
Efter at have husket de tre intermolekylære kræfter, kan vi nu relatere dem til stoffernes kogepunkt. Hedder kogepunkt temperaturen ved hvilken molekyler af et givet stof ophører med at være i flydende tilstand (har deres intermolekylære kræfter brudt) og skifter til en gasformig tilstand. Den interessante detalje er, at intermolekylære kræfter og kogepunktet af stoffer har et meget intenst og direkte forhold, da jo mere intens intermolekylær kraft, jo højere kogepunkt. Rækkefølgen af de intermolekylære kræfter er:
Induceret dipol
Således kan vi konkludere, at molekyler, der har hydrogenbindinger som en interaktionskraft, har højere kogepunkter end dem, der har dipoldipol og så videre. Nedenstående tabel viser tre stoffer og deres kogepunktsværdier:
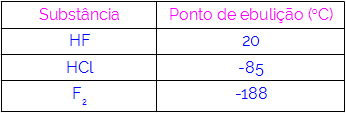
Vi observerer i tabellen, at HF har et højere kogepunkt, da dets molekyler er forbundet med hydrogenbindinger. Stof F2 den har det laveste kogepunkt, da dens molekyler tiltrækkes af en induceret dipol.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm



