Når vi tilbereder mad i vores hjem, bruger vi gas til forbrænding. En af de ting, vi kan se i flammen som følge af forbrændingen af denne gas, er at dens farve normalt er meget lyseblå. Imidlertid er flammen gul i de fleste forbrændingsreaktioner, såsom at brænde et lys.

Så opstår spørgsmålet:
"Hvis hver brand er resultatet af en forbrændingsreaktion, hvorfor har nogle flammer forskellige farver?"
For at forstå hvordan dette sker, skal vi forstå, hvad en forbrændingsreaktion er, og hvilke stoffer der er til stede i hver af de nævnte reaktioner.
En forbrændingsreaktion opstår, når et brændstof (oxiderbart materiale) forbruges af et oxidationsmiddel (et gasformigt materiale indeholdende ilt) for at generere termisk energi (varme).
Et andet vigtigt punkt, vi har brug for at vide om forbrændingsreaktioner, er at de kan finde sted i en komplet eller ufuldstændig. Hvis der er nok ilt til at forbruge brændstoffet, vil reaktionen være fuldstændig og producere kuldioxid (CO2) og vand (H2O). Ellers vil forbrændingen være delvis, ufuldstændig og generere kulilte (CO) og vand; eller kulstof (C) og vand.
I begge tilfælde analyserer vi, oxidatoren er iltet, der findes i luften. Dog er brændstoffer forskellige. Madlavningsgas er faktisk flydende gas (LPG), som er en blanding af kulbrinter (alkaner), hvor hovedbrændstoffet er butan (C4H10). Således består kogegas af alkanmolekyler, der kun har tre eller fire kulstofatomer, det er derfor, der kræves lidt ilt for at forbrændingen kan finde sted helt. Denne reaktion kan udtrykkes som følger:
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 timer2O(g), ∆H <0
I tilfældet med stearinlys er paraffinet brændstoffet til reaktionen, og det består af en blanding af alkaner med carbonatomer, der fra 20 til 36. Derved, det tager meget mere ilt, før denne reaktion finder sted fuldt ud. Se et eksempel:
1C24H50 (s) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2O(g), ∆H <0
I luften er der ikke nok ilt til at udføre denne komplette forbrænding, så det finder sted ufuldstændigt som vist nedenfor:
1C24H50 (s) +49/2 O2 (g) → 24 CO(g) + 25 H2O(g), ∆H <0
1C24H50 (s) +25/2 O2 (g) → 24C(s) + 25 H2O(g), ∆H <0
Ufuldstændige reaktioner producerer mindre energi end fuldstændig forbrænding. Dette forklarer forskellen mellem farverne på flammerne, da den gule flamme, der er karakteristisk for ufuldstændig forbrænding, har lavere energi. Den blå flamme er karakteristisk for en komplet forbrænding med større energi.
Dette forklarer også dannelsen af sod ved stearinlysflammen (billedet nedenfor), som kulstof betragtes som et produkt af ufuldstændig forbrænding.
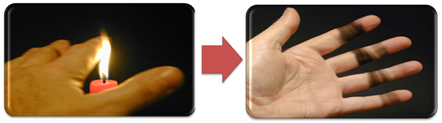
Men hvorfor er det i Bunsen-brænderen muligt at få gule og blå flammer, når brændstoffet ikke skifter?
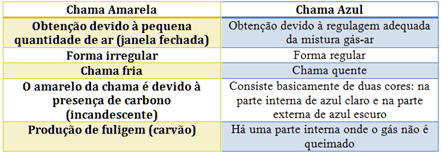
I tilfælde af Bunsen-brænderen opnås dette ved at regulere indløbet af gas og luft. Hvis vinduet lukkes og forårsager indtrængen af en lille mængde luft, vil den opnåede flamme være gul, fordi den har lidt ilt til at udføre fuldstændig forbrænding. Hvis reguleringen af gas-luft-blandingen er tilstrækkelig, får vi en blå flamme.
Se karakteristika for hver i tabellen nedenfor:
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
