Lær at anvende termodynamikkens første lov i forskellige situationer, løs øvelser og test din viden med løste og forklarede øvelser.
Spørgsmål 1
Termodynamikkens første lov siger, at:
a) Energi kan ikke skabes eller ødelægges, men den kan omdannes fra en form til en anden.
b) Energi er altid bevaret, men den kan ikke omdannes fra en form til en anden.
c) Energi kan skabes eller ødelægges, men den kan ikke omdannes fra en form til en anden.
d) Energi kan ikke bevares, men den kan omdannes fra en form til en anden.
Termodynamikkens første lov er princippet om energibevarelse, altså i et system lukket, forbliver mængden af energi konstant og kan kun omdannes fra en form til en anden. Andet.
spørgsmål 2
Antag et lukket system, der modtager 100 J varme, mens man udfører 50 J arbejde. Hvad er ændringen i systemets indre energi?
a) -50 J
b) 0 J
c) 50 J
d) 100J
e) 150J
Tjek af skiltene:
Varme modtaget er positiv Q > 0.
Udført arbejde er positivt W > 0.
I henhold til den første lov har vi:
spørgsmål 3
Et ideelt gassystem udveksler 500 joule varme med det ydre miljø. Forudsat at denne proces er en isometrisk afkøling, bestemmer du henholdsvis arbejdet og den indre energi.
a) 500 J og 0 J
b) - 500 og 0 J
c) 0 J og 500 J
d) 0 J og - 500 J
e) -500 J og 500 J
Da processen er isometrisk, er der ingen ændring i volumen, så arbejdet er nul.
Ifølge termodynamikkens første lov:
Da det er en afkøling, mister systemet varme, derfor:
spørgsmål 4
8 mol af en ideel gas i et stempel-cylinder-system komprimeres ved at udføre 1000 J arbejde. Under processen går 400 J varme tabt til det ydre miljø. Dens indre energi og ændringen i dens temperatur er henholdsvis lig med
Givet: R = 8,31 J/mol. K
a) - 1400 J og omtrentlig variation på 6 K
b) 600 J og omtrentlig variation på 6 K
c) 600 J og omtrentlig variation på 14 K
d) - 1400 J og omtrentlig variation på 14 K
indre energi
Da systemet modtager arbejde, er dets fortegn negativt, samt varmen, som i denne proces går tabt.
Termodynamikkens første lov er:
Ved at erstatte værdierne får vi:
R = 8,31 J/mol K
Temperatur
I henhold til Joules lov har vi:
spørgsmål 5
En perfekt gas undergår kompression og udfører 500 J arbejde. Ved slutningen af denne transformation ændrede systemets indre energi sig 200 J mindre end ved begyndelsen. Mængden af varme udvekslet af gassen var
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700J
Siden arbejdet blev modtaget, det vil sige modstandsdygtigt arbejde, er dets tegn negativt.
Substitution af værdierne i ligningen for termodynamikkens første lov:
spørgsmål 6
(CEDERJ 2021) I et trin af cyklussen, der udføres af en ideel gas i et klimaanlæg, øges gastrykket, mens dets volumen holdes konstant. På dette stadium af cyklussen er arbejdet W udført af gassen, mængden af varme Q absorberet af den og ændringen ΔT i dens temperatur henholdsvis:
a) W < 0, Q < 0 og ΔT < 0
b) W = 0, Q > 0 og ΔT > 0
c) W = 0, Q = 0 og ΔT = 0
d) W > 0, Q > 0 og ΔT > 0
Data:
Tryk P stiger;
Volumen forbliver konstant;
Arbejde
Da volumenet er konstant, er arbejdet W lig med nul.
Termodynamikkens første lov lyder således:
Da varme er positiv, vil ændringen i indre energi også være positiv.
Varme
Da varme absorberes, er den positiv.
Temperatur
I henhold til gasloven:
Hvor,
n er antallet af mol
R er den universelle gaskonstant
Temperaturen afhænger således kun af trykket, da volumenet er konstant, idet det er positivt.
spørgsmål 7
(UNICENTRO 2018) Ifølge den første lov om termodynamik er ændringen i den indre energi i et system, ΔU, givet ved forskellen mellem den varme, der udveksles med det ydre miljø, Q, og det arbejde, W, der udføres i processen termodynamisk. I betragtning af denne information, hvis en monatomisk gas udvider sig, så den altid forbliver ved den samme temperatur, kan denne transformation repræsenteres ved ligningen
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Isoterm proces sker uden temperaturændring.
Energi er relateret til temperatur ved:
Hvor n er antallet af mol, og R er den universelle gaskonstant. Da n og R er konstante, er der kun temperaturvariation, og
Termodynamikkens første lov lyder således:
spørgsmål 8
(URCA 2016) Ifølge termodynamikkens første lov, hvis gassen under en isoterm proces gennemgået af en ideel gas med fast masse frigives en varmemængde, hvis størrelse er 50 cal, så er ændringen i indre energi og arbejdet udført af gassen i denne proces, henholdsvis:
a) 0 og 50 cal.
b) 50 cal og 0.
c) 0 og 0.
d) 50 cal og -50 cal.
e) 0 og -50 cal.
Ændringen i indre energi er direkte relateret til ændringen i temperatur. Da processen er isotermisk, er der ingen temperaturændring, så .
Fra termodynamikkens første lov:
Da varme frigives, er dens fortegn negativt.
spørgsmål 9
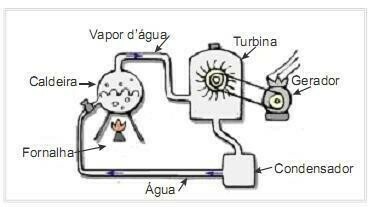
(UFRN 2012) Biomasse er en af de vigtigste kilder til vedvarende energi, og derfor er maskiner, der bruger den som brændstof til elproduktion, vigtige fra et miljømæssigt synspunkt. Et meget almindeligt eksempel er brugen af biomasse til at drive en dampturbine for at generere arbejde. Figuren på siden viser skematisk et forenklet termoelektrisk kraftværk.
I dette termoelektriske anlæg producerer afbrændingen af biomasse i ovnen varme, som opvarmer vandet i kedlen og genererer højtryksdamp. Dampen ledes på sin side gennem rør til turbinen, som under sin påvirkning begynder at rotere sine vinger.
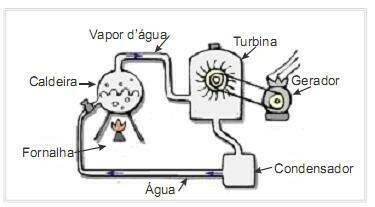
Antag at varmetab på grund af temperaturforskelle mellem delene af denne varmemotor og miljøet er ubetydelige. I denne sammenhæng variationen i kedelvandets indre energi
a) er større end summen af den varme, der tilføres den ved afbrænding af biomassen og arbejdet på turbinen.
b) er lig med summen af den varme, der tilføres den ved at brænde biomassen med arbejdet udført på turbinen.
c) er lig med forskellen mellem den varme, der tilføres den ved afbrænding af biomassen, og arbejdet udført på turbinen.
d) er større end forskellen mellem den varme, der tilføres den ved afbrænding af biomassen, og det arbejde, der udføres på turbinen.
Vandet i kedlen modtager energi i form af varme fra afbrænding af brændstoffet og frigiver energi i form af arbejde udført på turbinen.
spørgsmål 10
(UECE 2021) Med hensyn til gassers egenskaber skal du være opmærksom på følgende udsagn:
jeg. For en ideel gas er intern energi kun en funktion af tryk.
II. Den varme, der absorberes af en gas, når den ændrer sin tilstand, er uafhængig af processen.
III. Den indre energi af en ideel gas er kun en funktion af temperaturen og er uafhængig af processen.
IV. I en isotermisk udvidelse af en ideel gas er arbejdet udført af den lig med den absorberede varme.
Det er korrekt, hvad der kun står i
a) I og II.
b) III og IV.
c) I og IV.
d) II og III.
III. KORREKT. Den indre energi af en ideel gas er kun en funktion af temperaturen og er uafhængig af processen.
Ændringen i indre energi er direkte relateret til ændringen i temperatur.
Hvor n er antallet af mol, og R er den ideelle gaskonstant, idet det er konstanter, er det kun temperaturen, der bestemmer gassens indre energi.
IV. KORREKT. I en isotermisk udvidelse af en ideel gas er arbejdet udført af den lig med den absorberede varme.
Da det er isotermisk, er der ingen ændring i temperaturen, så ændringen i indre energi er nul. Ved termodynamikkens første lov:
Lær mere med:
- Termodynamikkens første lov
- Termodynamik: love, begreber, formler og øvelser
- Øvelser om termodynamik
- gasloven
ASTH, Rafael. Øvelser af termodynamikkens første lov.Alt betyder noget, [n.d.]. Tilgængelig i: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Adgang på:
Se også
- Øvelser om termodynamik
- Termodynamik
- adiabatisk transformation
- Øvelser i termokemi
- Termodynamikkens første lov
- Naturvidenskab og deres teknologier: Enem
- Termisk energi
- Termodynamikkens anden lov