Forsker Friedrich Kohlrausch (1840-1910) var den første til at foreslå, at rent vand leder elektricitet, omend i lille skala. Dette skyldes, at vand opfører sig på en amfoter måde; det vil sige, at det ved visse lejligheder fungerer som syre, der donerer protoner (H.+); og i andre opfører det sig som en base og modtager protoner.
Dette betyder, at vand udfører sin egen ionisering i henhold til den kemiske ligning vist nedenfor:
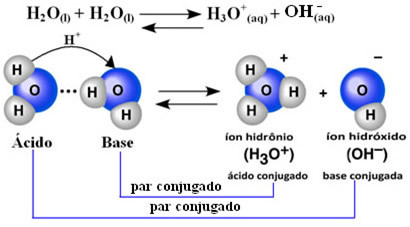
Denne proces kaldes vand autoionisering og det forekommer i meget lille skala, det vil sige vand er en meget svag elektrolyt med lave værdier af grad af ionisering og ioniseringskonstant ved ligevægt (Kç). Det er netop derfor, vand har så lav ledningsevne.
For at få en idé er det ved en omgivelsestemperatur på 25 ° C muligt at bestemme, at koncentrationerne af hydroxid og hydroniumioner, der produceres ved selvionisering af rent vand, er lig med 1. 10-7 mol. L-1. Dette betyder, at kun ud af en milliard vandmolekyler ioniserer.
Den ioniske balancekonstant for vand kaldes
çvand dissociation konstant,autoprotolysekonstanteller ionisk produkt af vand.Denne konstant er repræsenteret af Kw, fordi w henviser til ordet vand, som på engelsk betyder vand.Dens beregning udføres på samme måde som de andre ligevægtskonstanter, idet man husker, at som anført i teksten "Konstanter af Balance Kc og Kp ”, i dette tilfælde vises kun produkterne i udtrykket, fordi vand i flydende tilstand har samme aktivitet til 1. Rene flydende eller faste stoffer sættes ikke i dissociationens konstante udtryk, fordi de ikke ændrer sig. Kun vandige og gasformige opløsninger placeres. Så vi har:
Kw = [H3O+]. [åh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Som med de andre ligevægtskonstanter, Okayw det ændres kun med temperaturændringen. Når vandtemperaturen stiger, øges dets ionisering også, hvilket betyder, at selvionisering af vand er en endoterm proces, det vil sige, det absorberer varme.
Dette kan ses i vandets ioniske produktværdier (Kw) angivet i nedenstående tabel ved forskellige temperaturer:
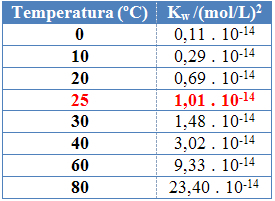
Det ioniske produkt af vand vil altid have en fast værdi ved hver temperatur, hvad enten det er i rent vand eller i opløsning. Selvom opløsningen har koncentrationer af H-ioner3O+ og åh- anderledes forbliver produktet imellem dem konstant.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm

