Organiske forbindelser kan repræsenteres på en række forskellige måder, såsom en flad strukturel formel, en forenklet eller kondenseret strukturel formel eller en bindestregsformel. Den enkleste repræsentation er dog via den molekylære formel.

Lad os således se, hvordan man bestemmer den molekylære formel for organiske forbindelser, baseret på de andre formler nævnt ovenfor.
1. Gennem den flade strukturformel:denne formel viser arrangementet eller arrangementet af atomer i molekylet. Nedenfor er for eksempel den flade strukturformel for et af de kulbrinter, der er til stede i benzin.

Bemærk, at i denne formel er alle atomer og alle eksisterende bindinger mellem dem vist. Nu, for at bestemme molekylformlen for denne forbindelse skal du blot tælle antallet af atomer i hvert grundstof og placere et indeks nederst til højre på det pågældende grundstof.
Et vigtigt aspekt, der skal fremhæves, er det vi starter altid molekylformlen for organiske forbindelser fra grundstoffet kulstof, da det er hovedbestanddelen af disse stoffer. Se eksemplet:
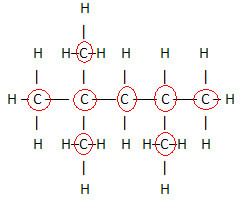
Da der er 8 carbonatomer, begynder vi at skrive molekylformlen sådan: Ç8
For at fuldføre denne formel tæller vi mængden af hydrogener:
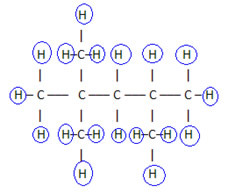
derfor din molekylær formel é Ç8H18.
2. Gennem den forenklede eller kondenserede strukturformel: i denne type formler er mængden af hydrogener forkortet. Se for eksempel på den samme formel for molekylet fundet i benzin, nu i en kondenseret form:
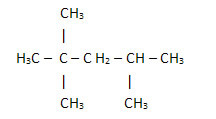
På denne måde er det endnu nemmere at tælle mængden af hydrogener, blot tilføje indekserne (3 +3+ 3 +2 +1 +3 +3 = 18).
Men lad os nu se på den kondenserede strukturformel af linolsyre, som findes i grøntsager som bomuld, sojabønner, solsikker osv. og som bruges i maling og lak:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Når vi tæller mængden af kulstof, brint og oxygen, har vi følgende molekylær formel linolsyre: Ç18H32O2.
3. Gennem slagtilfældeformlen: denne formel forenkler yderligere, hvordan man repræsenterer organiske forbindelser, da den udelader grupperne C, CH, CH2 og CH3.
Et eksempel er linolmolekylet, se hvordan det ser ud:

Lad os først tælle mængden af kulstof, og husk, at hver binding mellem kulstof i denne formel er repræsenteret med bindestregen. Således svarer spidserne, såvel som de to bøjningspunkter, til kulstofatomer.
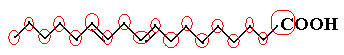
Så vi har: Ç18
For at tælle mængden af hydrogener skal vi huske, at bindingerne mellem carboner og hydrogener er underforstået, da carbon er kendt for at danne fire bindinger; således er mængden af bindinger, der mangler, mængden af hydrogen bundet til det element.
Se forklaringerne nedenfor:
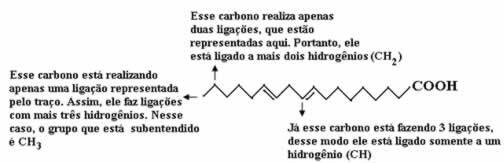
Mængden af hydrogener vil således være: 32.

Mængden af ilt er ret simpel at tælle, da der kun er to. Siden molekylær formel é: Ç18H32O2.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
