Blandt de intermolekylære kræfter er inducerede dipol-inducerede dipolkræfter de er de eneste, der ikke er studeret af den hollandske fysiker Johannes Diederik Van der Waals (1837-1923). De blev belyst af den tyske fysiker Fritz Wolfgang London (1900-1954), så disse kræfter kaldes også london styrker eller london spredningskræfter. Et andet navn givet til disse kræfter er øjeblikkelig dipol-induceret dipol.
Denne form for kraft opstår i ikke-polære stoffer, såsom H2, O2, F2, Cl2, CO2, CH4 og C2H6, blandt andre. Og de kan også forekomme imellem ædelgas atomer, når de nærmer sig, hvilket forårsager frastødning mellem deres elektrosfærer. På den måde samler elektronerne sig på en bestemt side, som er negativt polariseret og den modsatte side positivt, på grund af den negative ladningsmangel.
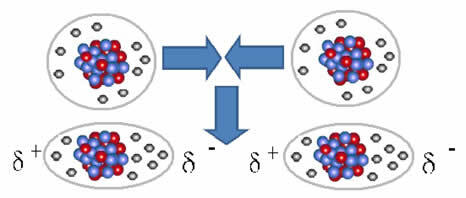
Ikke-polære molekyler kan gå fra en gasformig tilstand - hvor de er meget langt fra hinanden, og der er ingen vekselvirkning, da der ikke er poler - til en flydende og fast tilstand. I disse aggregeringstilstande er molekylerne tættere på, og de elektroniske tiltrækninger eller frastødninger mellem deres elektroner og kerner kan føre til en deformation af deres elektroniske skyer, momentant, med oprindelse i positive og negative poler midlertidig.
Øjeblikkelige dipoler kan inducere polarisering af tilstødende molekyler, hvilket resulterer i tiltrækkende kræfter.
Denne induktion kan også forekomme. mellem forskellige molekyler og generelt disse kræfter er svagere i intensitet end dipol-dipol- og hydrogenbindingsstyrkerne. Derfor er faste stoffer med denne interaktionsstyrke, såsom tøris (kuldioxid - CO2) og jod (I2), som er i fast tilstand, sublime (gå til gasform); fordi den nødvendige energi til at forstyrre deres interaktioner er lille.
Et eksempel på intermolekylære kræfter mellem polære og upolære molekyler forekommer mellem oxygengas (ikke-polær) og vand (polær). Det viser sig, at den negative ende af vandet nærmer sig O2 og frastøder sig selv, og dermed bevæger den elektroniske sky af det ikke-polære molekyle sig væk. Ilten polariseres derefter et øjeblik og begynder at interagere med vandet og opløses i det.
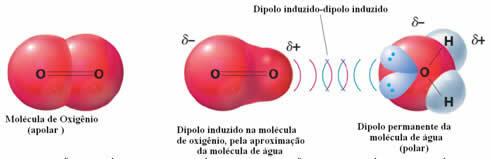
Da disse kræfter er svage, er opløseligheden af denne gas i vand lille. Alligevel er dets tilstedeværelse afgørende for at bevare livet for forskellige vandlevende organismer.
Denne vekselvirkningskraft opstår også i naturen, hvilket giver vedhæftning mellem gekkoernes poter og overfladen, som de går på. Derfor kan de gå på vægge og lofter uden at falde eller klæbe.
Af Jennifer Fogaça
Uddannet i kemi
Brasiliens skolehold
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm

