DET entalpi er en termodynamisk funktion, hvorved beregner varmen involveret i isobariske processer, det vil sige, der holdes under konstant pres. Dens udvikling fandt sted kort efter faldet af kalorieteorien, med fremskridt af termodynamik mellem 1840 og 1850.
Entalpien, for hvadumica, har ikke meget betydning, hvis det arbejdes som en absolut og isoleret værdi, men det gør det, når man betragter variation af dets værdi i en kemisk proces. Der er flere måder at beregne entalpivariationen på en proces, de vigtigste er gennem energierne fra dannelse, binding og også ved derhej fra hess.
Læs også: Hvad er Gibbs Free Energy?
Entalpi Resumé
Entalpi er et termodynamisk værktøj til at beregne den varme, der er involveret i processer, der foregår ved konstant tryk.
Det blev defineret af den amerikanske fysiker Josiah W. Gibbs, i forbindelse med kaloriteoriens fald.
I kemi bruger vi altid entalpiændringen, repræsenteret som ΔH.
Kemiske reaktioner, der absorberer varme, kaldes endoterme og har ΔH > 0.
Kemiske reaktioner, der frigiver varme, kaldes eksoterme og har ΔH < 0.
Video lektion om entalpi
Hvad er entalpi?
Entalpien, altid repræsenteret ved H, var oprindeligt defineret af den amerikanske fysiker Josiah Willard Gibbs, som han kaldte varme ved konstant tryk funktion, da, med hans ord:
"[...] faldet i funktion repræsenterer, i alle tilfælde, hvor trykket ikke varierer, den varme, som systemet afgiver."
Fra Gibbs' arbejde kan vi altså forstå entalpi som en termodynamisk funktion, hvis variation er numerisk lig med mængden af varme, der udveksles i systemet, til tryk konstant. Dette betyder, at i isobariske processer (som de fleste kemiske processer), at vide beregne variationen af entalpifunktionen, kan man så kende værdien af varmevekslet mellem system og kvarter.

En sådan sammenhæng med varme forårsager mange elever tror fejlagtigt, at entalpi er synonymt med varme eller noget som energiindhold, varmeindhold, frigivet varme og optaget varme og lignende.
Entalpien opstod i forbindelse med kollapset af kalorieteorien, der behandlede varme som et uoverskueligt stof, der blev overført fra varmere kroppe til koldere kroppe. Der var således behov for et nyt værktøj til at beregne varme. Løsningen var altså at bruge mængder, der allerede havde defineret termodynamiske ligninger, såsom entalpi.
Læs også: Hvordan beregnes entalpiændringen af opløsning?
entalpi variation
Da entalpi er et værktøj, der bruges til at beregne den varme, der udveksles i en kemisk proces, giver det ingen mening at bruge det som et absolut, isoleret tal, men i betragtning af dens variation, dvs. i praksis, bør vi kun vurdere, hvor meget, numerisk, entalpien ændrede sig under den kemiske proces, da termodynamikken forsikrer os om, at dens variation er numerisk lig med den varme, der frigives eller absorberes i processen.
Strengt taget kan vi definere entalpivariationen som:
ΔH = HFinale - Hinitial
Som i kemiske processer kan det sidste trin betragtes som produkterne, og det indledende trin kan betragtes som reagenserne. Det er også almindeligt at se definitionen af entalpivariation som:
ΔH = HProdukter - Hreagenser
Fra et praktisk og fortolkende synspunkt, hvis entalpiændringen er positiv (ΔH> 0), siger vi, at den kemiske reaktion er endotermiskdet vil sige, at der er varmeabsorption gennem hele processen. Allerede hvis entalpiændringen er negativ (ΔH< 0), siger vi, at den kemiske reaktion er eksotermisk, det vil sige, at der frigives varme under hele processen.
Entalpivariationen er i mange tilfælde observeret i grafer, som vist i de følgende eksempler.
Eksempel 1:
Endotermisk reaktionsdiagram
I entalpigraferne for endoterme reaktioner kan det ses, at mængden af entalpi af produkterne er større end for reaktanterne, hvilket indikerer, at variationen langs reaktionen er positiv. Således, hvis ΔH > 0, kan vi sige, at den kemiske proces fandt sted med varmeabsorption.
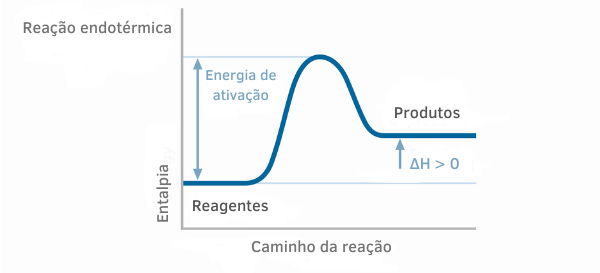
Eksempel 2:
Eksotermisk reaktionsdiagram:
I entalpigraferne for eksoterme reaktioner kan det ses, at mængden af entalpi af produkterne er mindre end reaktanternes, hvilket indikerer, at variationen langs reaktionen er negativ. Da ΔH < 0, kan vi sige, at den kemiske proces fandt sted med frigivelse af varme.
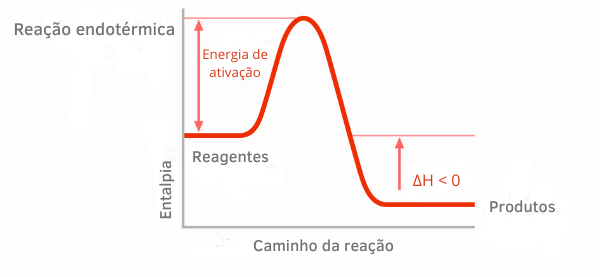
Læs mere om disse klassifikationer af kemiske reaktioner i teksten: TILendoterme og eksoterme processer.
Typer af entalpi
dannelsesentalpi
DET dannelsesentalpi é beregnet baseret på dannelse af kemiske reaktioner, som er reaktioner, hvor et mol sammensatte stoffer dannes af deres mest stabile simple stoffer ved stuetemperatur og 1 atmosfæres tryk.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
Den store fordel ved dannelsesentalpien er, at simple stoffer, der er mere stabile ved stuetemperatur og 1 atmosfæres tryk, har en entalpi aftalt til nul. Dermed ikke sagt, at de faktisk er nul, men for forenkling og bedre klassificering behandles de sådan.
Væren H = HProdukter - Hreagenser, hvis vi tænker på, at Hreagenser = 0, kan vi sige, at den observerede værdi af ΔH kun er relateret til produkterne, som i disse tilfælde altid er et mol af det sammensatte stof. Derfor angiver vi denne værdi som standardentalpivariationen af vanddannelse, repræsenteret ved ΔH°f.
Det var med denne metodik, at flere stoffer havde deres variationer af standard entalpi formationstabeller, som vi kan se nedenfor.
Stof |
Dannelsesentalpi (ΔH°fi kJ/mol |
CO2 (g) |
-393,4 |
CaO(er) |
-634,9 |
HI(g) |
+25,9 |
NEJ (g) |
+90,1 |
bindende entalpi
Bindingsentalpien tjener til at angive mængden af energi involveret i brud eller dannelse af en given muldvarp. kemisk binding.
Det er underforstået, at for at bryde en kemisk binding er det nødvendigt at absorbere varme, så bindingsatomerne øger deres indre energi og dermed øge din kinetiske energi. med større kinetisk energi, vibrerer atomerne mere intenst, hvilket får bindingerne til at bryde. Således er enhver bindingsbrud en endoterm proces.
Ellers, for at danne en kemisk binding, mister atomer bevægelsesfriheden og skal reducere deres bevægelsesgrad, hvilket reducerer deres kinetiske energi. Den ekstra energi frigives derefter i form af varme. Dermed, al bindingsdannelse er en eksoterm proces.
Tabellen nedenfor viser værdier af energierne forbundet med hver kemisk binding.
Forbindelse |
Bindingsenergi (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
INGEN |
943,8 |
Bemærk, at der ikke er nogen tegn i værdierne, da de er i modul. Dette skyldes, at signalet skal tildeles af dig afhængigt af om linket er brudt eller dannet.
Forbrændingsentalpi
DET forbrændingsentalpi tjener til at angive mængden af varme, der frigives ved forbrændingen af et mol af et stof. Det skal bemærkes, at enhver forbrændingsreaktion er eksoterm, da hver forbrænding frigiver varme.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 kJ/mol
Tabellen nedenfor viser entalpi for forbrændingsværdier for nogle kemiske stoffer.
Stof |
Forbrændingsentalpi (ΔH°Çi kJ/mol |
Ethanol - C2H5ÅH (1) |
-1368 |
Benzen - C6H6 (1) |
-3268 |
Oktan - C8H18 (1) |
-5471 |
Glukose - C6H12O6 (s) |
-2808 |
Entalpi af fysisk tilstandsændring
Enhver ændring i fysisk tilstand involverer varmeudveksling. Derfor er entalpi for ændring af fysisk tilstand tjener til at angive mængde varme involveret i fysiske tilstandsændringsprocesser.
For eksempel har vi vandfordampning:
H2O (1) → H2O (g) AH = +44 kJ/mol
Ved smeltning af vand har vi:
H2O(s) → H2O (1) AH = +7,3 kJ/mol
Entalpiværdier er symmetriske for inverse processer, hvilket betyder, at f.eks. entalpiændringen ved fortætning af vand er -44 kJ/mol, mens den i sin størkning er lig med -7,3 kJ/mol.
Læs også: Hvad er entropi?
Løste øvelser om entalpi
Spørgsmål 1 - (UERJ 2018) Forureningskapaciteten af et kulbrinte, der bruges som brændstof, bestemmes af forholdet mellem den frigivne energi og mængden af CO2 dannet i dens fuldstændige forbrænding. Jo højere forholdet er, jo lavere er forureningskapaciteten. Tabellen nedenfor viser standardentalpien for forbrænding af fire kulbrinter.

Fra tabellen er kulbrinte med den laveste forurenende kapacitet:
Oktan
Hexan
Benzen
pentan
Løsning
Alternativ D
Spørgsmålet indikerer, at den forurenende kapacitet er defineret som forholdet (kvotienten) mellem den frigivne energi og mængden af CO2 dannet i dens fuldstændige forbrænding. Jo større grund, jo lavere forureningskapacitet, det vil sige, at der frigives mere energi pr. mol CO2 genereret.
De fuldstændige forbrændingsreaktioner af Kulbrinter citeret er:
Oktan: Ç8H18 +25/2 O2 → 8 CO2 + 9 timer2Årsagen: 5440/8 = 680
Hexan: Ç6H14 +19/2 O2 → 6 CO2 + 7 timer2Årsagen: 4140/6 = 690
Benzen: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Årsagen: 3270/6 = 545
pentan: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Årsagen: 3510/5 = 702
Således kan vi konkludere, at pentan er det kulbrinte med den laveste forurenende kapacitet.
Spørgsmål 2 - (Enem 2015) Brugen af skovrester bliver mere attraktiv for hver dag, da de er en vedvarende energikilde. Figuren repræsenterer afbrændingen af en bioolie udvundet af træaffald, hvor ΔH1 entalpivariationen på grund af afbrændingen af 1 g af denne bioolie, hvilket resulterer i kuldioxid og flydende vand og ΔH2 entalpiændringen involveret i omdannelsen af 1 g vand i gasform til flydende tilstand.

Entalpivariationen, i kJ, for forbrænding af 5 g af denne bioolie, hvilket resulterer i CO2 (gasformig) og H2Den (gasformige) er:
A) -106
B) -94
C) -82
D) -21,2
E) -16,4
Løsning
Alternativ C
Fra den viste graf har vi ΔH1 som entalpivariationen af bioolieforbrænding, der producerer CO2 (g) og H2O (1) og AH2 som entalpiændringen ved fortætning af vand, da CO2 forbliver gasformig og kun den fysiske tilstand af Vand ændringer (fra gas til væske).
Øvelsen beder om entalpiændringen ved at forbrænde 5 g bioolie, hvilket resulterer i CO2 (gasformig) og H2O (gasformig). Fra diagrammet kan denne entalpiændring defineres som ΔH = ΔH1 – H2. Værdien af ΔH vil således være lig med -16,4 kJ/g. Denne variation, som vi kan se i enheden, er for HVERT gram bioolie. For 5 gram skal vi gøre det del:
1 g bio-olie -16,4 kJ
5 g bioolie x
1. x = 5. (-16,4)
x = -82 kJ
Vi kan så markere alternativ C.
Af Stéfano Araújo Novais
Kemi lærer

