Oxidation er navnet givet til processen med tab af elektroner af et atom, en gruppe eller en ionart under en kemisk reaktion. Det er identificeret fra stigningen i NOX (oxidationstal) af arten eller atomet, når man sammenligner reaktant og produkt.
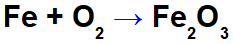
Jernoxidationsligning.
I ligningen ovenfor kan vi for eksempel angive NOX for hver af deltagerne:
Reagensjern (Fe): har NOX 0, da det er en simpelt stof;
Ilt i reagens (O): har NOX 0, da det er et simpelt stof;
Ilt i produktet: det har NOX -2, fordi det ikke er forbundet med et alkalimetal, alkalisk jord eller hydrogendannelse peroxider eller superoxider;
Jern i produktet: det har NOX +3, fordi summen af jernets NOX ganget med 2 (antal atomer) + NOX oxygen ganget med 3 skal resultere i 0, da det er et sammensat stof:
x, 2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Ved at sammenligne NOX for reagensjernet (0) med produktet (+3), observerede vi en stigning, det vil sige, at det gennemgik processen med oxidation. Det er værd at bemærke, at forekomsten af
oxidation det er altid ledsaget af fænomenet reduktion (som betyder forstærkning af elektroner), identificeret ved faldet i NOx, som det sker med oxygen i eksemplet.Læs også:Bestemmelse af oxidationstal (NOX)
Eksempler på situationer, hvor oxidation forekommer:
1. Forbrænding

Forbrændingen af et materiale er også tegn på oxidation.
Forbrænding er enhver kemisk reaktion, der finder sted i nærværelse af en brændstof enhver og den oxiderende oxygengas (O2), hvilket resulterer i produktion af varme og lys. I hver forbrændingsreaktion opstår oxidation.
2. Nogle organiske reaktioner
I hver organisk reaktion, der finder sted i nærværelse af de midler, der er anført nedenfor, processen med oxidation:
Kaliumdichromat (K2Cr2O7) eller kaliumpermanganat (KMnO4);
Tilstedeværelse af stærk syre eller stærk base;
Ozongas (O3) i nærværelse af metallisk zink (Zn) og vand (H2O).
3. Batterier eller batterier

Batterier er enheder, hvori der altid forekommer oxidation.
Stabler eller batterier er elektrokemiske enheder, der opbevarer kemiske stoffer. Et af disse stoffer vil undergå oxidation, og det andet vil gennemgå reduktion, hvilket resulterer i produktion af elektrisk strøm.
4. Elektrolyse
Elektrolyse er en kemisk proces, hvor en vandig opløsning indeholdende et salt udsættes for en elektrisk strøm, som ender med at fremme oxidationen af anioner i disse materialer. I al elektrolyse er der oxidation.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm