Du basiske oxider det er dem, der, når de reagerer med vand, giver anledning til baser. Når de reagerer med en syre, danner de salt og vand.
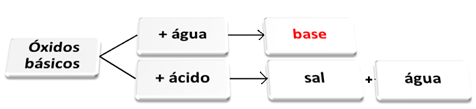
Basiske oxider, der reagerer med vand og syre.
For eksempel har vi natriumoxid (Na2O), som er et basisk oxid. Se nedenfor, at når det reagerer med vand, danner det natriumhydroxidbase:
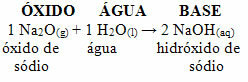
Hvis det samme oxid reagerer med en syre såsom svovlsyre (H2KUN4), et salt (natriumsulfat) og vand vil blive produceret.
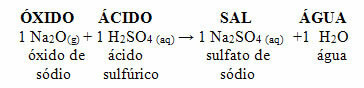
Hvis et basisk oxid reagerer med et surt oxid, dannes der også et salt, men uden vandet.
Som vist i det viste eksempel er de andre basiske oxider også ioniske forbindelser, der dannes i deres for det meste af metaller, grundstoffer, der er meget elektropositive, som normalt præsenterer en "ladning" lig med +1 eller +2.
Eksempler:
På2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Disse forbindelser har høje smelte- og kogepunkter og omslutter alle oxygenanionen (O2-).
Anvendelser af nogle grundlæggende oxider:
• Hund: Calciumoxid
Denne forbindelse er almindeligvis kendt som
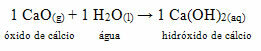

Hvidmalet maleri.
• K2O: kaliumoxid
Kaliumoxid findes almindeligvis i træ og cigaretaske. Når det reagerer med vand, danner det basen kaliumhydroxid (KOH), der bruges til fremstilling af sæber. Selv tidligere, på steder, hvor der ikke var KOH, blev der brugt vegetabilsk aske, som indeholdt K2O, at reagere med fedtstoffer og producere den såkaldte "grå sæbe".
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/oxidos-basicos.htm