Stoffernes molekyler er ikke alle lige, som om de var i et enkelt plan. De er trods alt spredt i rummet, og deres atomer antager forskellige arrangementer eller arrangementer. Der er således forskellige geometriske former for hver stoftypes molekyler.
En af de enkleste måder at bestemme et molekyles geometri på er baseret på teorien om frastødning af valensskalelektronpar (RPECV). Ifølge denne teori fungerer centralatomets elektronpar som elektroniske skyer der frastøder hinanden. På denne måde er de orienteret så langt væk fra hinanden som muligt. Molekylær geometri vil afhænge af antallet af elektroniske par omkring det centrale atom.
Denne elektroniske sky kan være sammensat af elektroner, der deltager i bindinger (enkelt, dobbelt eller tredobbelt), og som også ikke deltager. Så vi har:
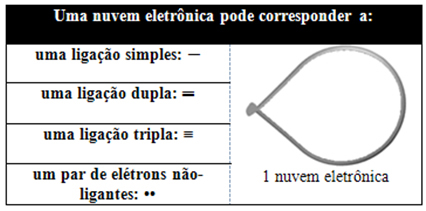
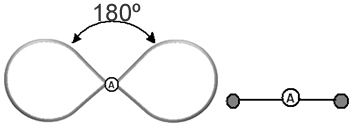
Det hjælper at tænke på denne sky som en tøjret ballon eller balloner, med det centrale atom i midten af dem. For eksempel i et molekyle, der kun har to elektronskyer omkring det centrale atom, jo større mulig afstand mellem dem er en vinkel på 180º, og derfor vil molekylets geometri være lineær.
Derfor kan vi udlede om, hvordan de fleste molekylers molekylære geometri vil være, hvis vi tager højde for antallet af atomer i molekylerne og de bindinger, som det centrale atom laver, ved at kontrollere, om det har par af elektroner.
Se eksemplerne nedenfor:
- Molekyler med 2 atomer: vil altid være det lineær
For eksempel:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- 3-atom molekyle: kantet eller trekantet
hvis det centrale atom besidder et par ikke-bindende elektroner geometrien vil være kantet, som i tilfældet med SO-molekylet2:
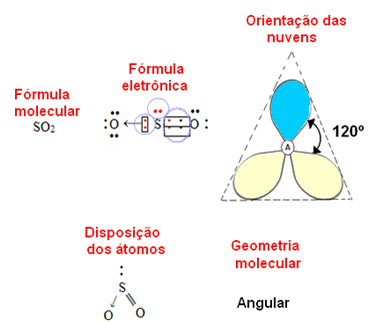
Betragt den blå elektronsky for at repræsentere par af elektroner, der ikke deltager i bindingerne, og den gule for at være par af elektroner, der deltager i bindingerne.
- 4-atom molekyle: plan trigonal (eller trekantet) eller pyramideformet (eller trigonal pyramide)
Hvis det centrale atom ikke har et uparret (ikke-bindende) elektronpar, er den molekylære geometri flad trigonal (eller trekantet). Se på BF-eksemplet3:

Hvis atomet har ikke-bindende elektronpar, vil molekylets geometri være pyramideformet (eller trigonal pyramide), som i tilfældet med ammoniak:

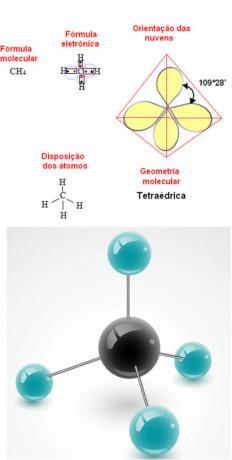
- 5-atom molekyle: tetraedrisk
Eksempel på metangeometri:
- Molekyle med 6 atomer: trigonal bipyramide eller trekantet pyramide.
Et eksempel er phosphorpentachlorid (PCl5), som har nogle forbindelser mellem fosfor og klor i en vinkel på 90º og andre på 120º, der danner en bipyramide med en trekantet base:
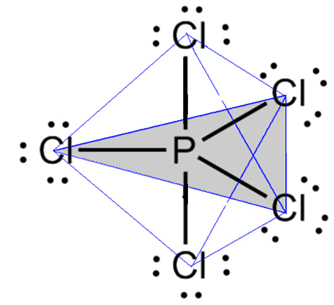
- 7-atom molekyle: oktaedral
Eksempel: svovlhexafluorid (SF6), hvis vinkler er 90º.

Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm
