Kemisk isomerisme er et fænomen, der observeres, når to eller flere organiske stoffer har den samme molekylformel, men forskellige molekylære struktur og egenskaber.
Kemiske stoffer med disse egenskaber kaldes isomerer.
Udtrykket stammer fra de græske ord iso = lige og mere = dele, det vil sige lige store dele.
Der er forskellige typer isomerisme:
- flad isomer: Forbindelser identificeres med flade strukturformler. Det er opdelt i kædeisomerisme, funktionsisomerisme, positionisomerisme, kompensationsisomerisme og tautomerismeisomerisme.
- rumisomer: Molekylær struktur af forbindelser har forskellige rumlige strukturer. Det er opdelt i geometrisk og optisk isomerisme.
flad isomer
På flad isomerisme eller konstitutionel isomerisme, er den molekylære struktur af organiske stoffer flad.
Forbindelser, der udviser denne egenskab kaldes flade isomerer.
kædeisomer
Kædeisomerisme sker, når kulstofatomer har forskellige kæder og samme kemiske funktion.
Eksempler:
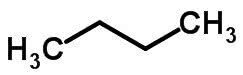
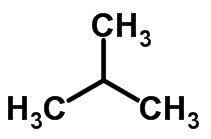
Funktion Isomerisme
Funktionsisomerisme opstår, når to eller flere forbindelser har forskellige kemiske funktioner og den samme molekylære formel.
Eksempler: Denne sag er almindelig mellem aldehyder og ketoner.
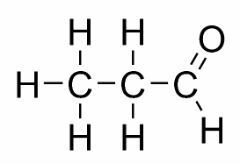
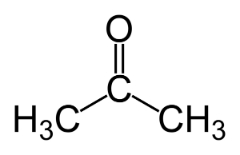
Positionsisomer
Positionsisomerisme opstår, når forbindelser differentieres ved forskellige umættede, forgrenede eller funktionelle gruppepositioner i carbonkæden. I dette tilfælde har isomererne den samme kemiske funktion.
Eksempler:

modregning af isomer
Kompensationsisomerisme eller metamerisme forekommer i forbindelser med samme kemiske funktion, som adskiller sig efter placeringen af heteroatomer.
Eksempler:

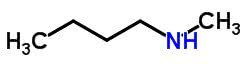
Automater
Tautomerisme eller dynamisk isomerisme kan betragtes som et specifikt tilfælde af funktionsisomerisme. I dette tilfælde kan en isomer skifte til en anden ved at ændre placeringen af et element i kæden.
Eksempler:

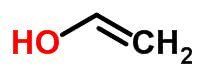
rumisomer
DET rumisomerisme, også kaldet stereoisomerisme, sker, når to forbindelser har samme molekylformel og forskellige strukturformler.
I denne type isomerisme fordeles atomer på samme måde, men indtager forskellige positioner i rummet.
geometrisk isomer
DET geometrisk isomerisme eller cis-trans forekommer i umættede åbne kæder og også i cykliske forbindelser. For at gøre dette skal carbonliganderne være forskellige.

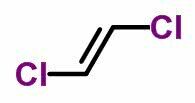
- Når de samme ligander er på samme side, modtager isomernomenklaturen præfikset cis.
- Når de samme ligander er på modsatte sider, modtager nomenklaturen præfikset trans.
IUPAC (International Union of Pure and Applied Chemistry) anbefaler, at bogstaverne Z og E bruges som præfiks i stedet for cis og trans.
Dette skyldes, at Z er det første bogstav i det tyske ord zusammen, hvilket betyder "sammen". Og det er det første bogstav i det tyske ord entegegen, hvilket betyder "modsat".
optisk isomer
DET optisk isomerisme demonstreres af forbindelser, der er optisk aktive. Det sker, når et stof er forårsaget af vinkelafvigelsen i planet for polariseret lys.
- Når et stof bøjer optisk lys til højre kaldes det højrehåndet.
- Når et stof bøjer optisk lys til venstre, kaldes stoffet levorotary.
Et stof kan også eksistere i to former, der er optisk aktive, dextogyra og levogyra. I dette tilfælde kaldes det enantiomer.
For at en kulstofforbindelse skal være optisk aktiv, skal den være chiral. Dette betyder, at deres ligander ikke kan overlappe hinanden, da de er asymmetriske.
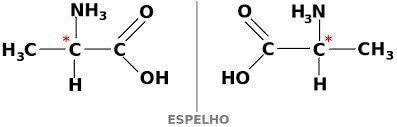
Til gengæld kaldes de, hvis en forbindelse har dextrogyra- og levorotære former i lige store dele racemiske blandinger. Den optiske aktivitet af racemiske blandinger er inaktiv.
Læs også:
- Kulstof
- Organisk kemi
- Molekylær formel
- strukturformel
Øvelser
1. (Mackenzie 2012) Nummerkolonne B, som indeholder organiske forbindelser, der forbinder dem med kolonne A i henhold til den type isomerisme, som hvert organiske molekyle præsenterer.
Kolonne A
1. modregning af isomer
2. geometrisk isomer
3. kædeisomer
4. optisk isomer
Kolonne B
() cyclopropan
() ethoxyethan
() brom-chlor-fluor-methan
() 1,2-dichlorethen
Den korrekte rækkefølge af tal i kolonne B, fra top til bund, er
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternativ b) 3 - 1 - 4 - 2.
2. (Uerj) Isomery er det fænomen, der er kendetegnet ved, at den samme molekylære formel repræsenterer forskellige strukturer.
I betragtning af den flade strukturelle isomerisme for molekylformlen C4H8, kan vi identificere isomerer af følgende typer:
a) kæde og position
b) kæde og funktion
c) funktion og kompensation
d) position og kompensation
Alternativ a) streng og position
3. (OSEC) Propanon og isopropenol eksemplificerer et tilfælde af isomerisme:
a) af metameria
b) funktion
c) af automater
d) cis-tran
e) kæde
Alternativ c) af tautomery
Se også: Øvelser på flad isomerisme



