Elektrolyse er en fysisk-kemisk proces, der bruger elektrisk energi fra enhver kilde (f.eks batteri eller batteri) for at tvinge forekomsten af en kemisk reaktion til at producere enkle eller sammensatte stoffer, der ikke findes i naturen, eller som ikke findes i store mængder.
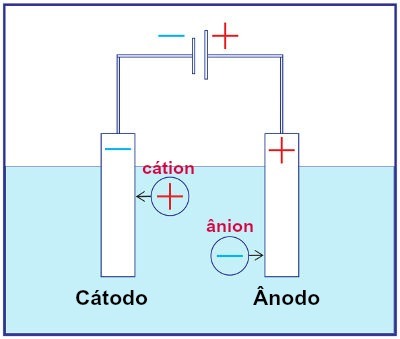
Repræsentation af samlingen af ethvert elektrolysesystem
Under elektrolyse undergår en kation reduktion ved katoden, og en anion gennemgår oxidation ved anoden. Dette sker gennem elektrisk afladning fra en ekstern kilde. Således har vi i elektrolyse en ikke-spontan oxidations- og reduktionsreaktion.
Forstå nu de to måder, som elektrolyse opstår på:
I denne type elektrolyse bruger vi en ionisk stof i flydende tilstand i et elektrolytisk kar. Når det ioniske stof (XY) gennemgår fusion, gennemgår det processen med dissociationsom vist nedenfor:
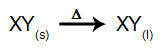

Derefter, når strømkilden er tændt, kationen (X+) bevæger sig mod katoden, og anionerne (Y-) bevæger sig mod anoden. Derved:
Ved katoden: kationerne modtager elektroner (de gennemgår reduktion) og omdannes til et stabilt stof (X), en proces repræsenteret af følgende ligning:
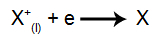
Ved anoden: anioner mister elektroner (de gennemgår oxidation) og bliver et stabilt stof (X), en proces repræsenteret af følgende ligning:

a) Eksempel på magmatisk elektrolyse
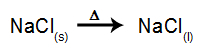
Som et eksempel, følg nu den magtfulde elektrolyse af natriumchlorid (NaCl). Når natriumchlorid (NaCl) gennemgår fusion, gennemgår det dissociationsprocessen som vist nedenfor:
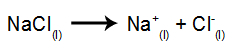
Derefter, når strømkilden er tændt, kationen (Na+) bevæger sig mod katoden, og anionerne (Cl-) bevæger sig mod anoden. Derved:
Ved katoden: kationerne i+ de modtager elektroner (de gennemgår reduktion) og bliver et stabilt stof (Na, som er et fast metal), en proces repræsenteret af nedenstående ligning:

Ved anoden: Cl-anionerne- de mister elektroner (de gennemgår oxidation) og bliver et stabilt stof (Cl2, som er gasformig), proces repræsenteret ved nedenstående ligning:

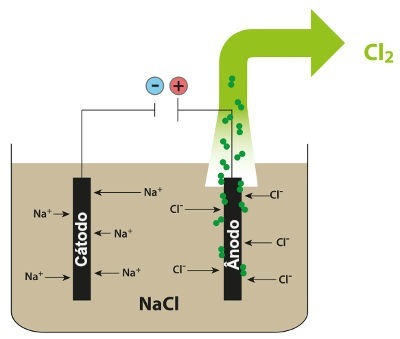
Skema, der demonstrerer den magtfulde elektrolyse af NaCl
I den stødende elektrolyse af natriumchlorid har vi således dannelsen af metallisk natrium (Na) og klorgas (Cl2).
I denne type elektrolyse bruger vi et ionisk stof opløst i vand inde i den elektrolytiske tank. Så inden vi udfører elektrolysen, blander vi først stoffet (normalt et salt uorganisk) i vand for at forårsage dets dissociation (frigivelse af en kation og en anion), som vist bælge:
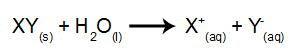
Forskellen i forhold til magtlig elektrolyse er, at vi foruden ioner fra dissociation også har ioner fra selvionisering af vand. I sin selvionisering producerer vand en hydroniumkation (H.+og en hydroxidanion (OH-), som i ligningen nedenfor:

Således inden i det elektrolytiske kar har vi tilstedeværelsen af to kationer (en fra stoffet ionisk og en fra vand) og to anioner (en fra det ioniske stof og den anden fra Vand).
For at vide, hvilken kation der bevæger sig til katoden, og hvilken anion der bevæger sig til anoden, er det nødvendigt at kende rækkefølgen af udledning af kationer og anioner.
Til kationer:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hydronium> IIIA-familie> IIA-familie> IA-familie
til anioner
Ikke-iltede anioner og HSO4 > hydroxid> iltede anioner og F
Derefter, når strømkilden er tændt, en kation (X+) bevæger sig mod katoden, og en af anionerne (Y-) bevæger sig mod anoden.
Ved katoden: kationerne modtager elektroner (de undergår reduktion) og omdannes til et stabilt stof (X), en proces repræsenteret af nedenstående ligning:

Ved anoden: anioner mister elektroner (de gennemgår oxidation) og bliver til en stabil substans (Y), en proces repræsenteret af nedenstående ligning:
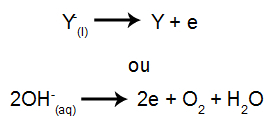
a) Eksempel på vandig elektrolyse
Som et eksempel vil vi bruge vandig elektrolyse af natriumchlorid (NaCl). Når natriumchlorid (NaCl) opløses i vand, gennemgår det dissociationsprocessen som vist nedenfor:
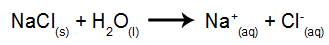
Ud over dissociationen af NaCl har vi selvionisering af vand:

Så vi har H-kationerne+ og på+ og OH-anionerne- og Cl-. Derefter, når strømkilden er tændt, har vi følgende:
ved katoden: H-kationerne+ modtage elektroner (reduceret) og blive et stabilt stof (H2, som er en gas). Dette skyldes, at hydronium har udledningsprioritet over elementerne i IA-familien (i dette tilfælde Na). Processen er repræsenteret ved nedenstående ligning:
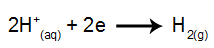
ved anode: Cl-anionerne- de mister elektroner (de gennemgår oxidation) og bliver et stabilt stof (Cl2, som er gasformig). Dette skyldes, at Cl- det er en ikke-iltet anion og har udledningsprioritet over hydroxid, en proces repræsenteret af nedenstående ligning:


Skema, der demonstrerer den vandige elektrolyse af NaCl
Således har vi i den vandige elektrolyse af natriumchlorid dannelsen af hydrogengas (H2) og chlorgas (Cl2).
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm
