Teorien om Arrhenius:
Baseret på hans eksperimenter med elektrisk ledningsevne i vandige medier, det kemiske, fysiske og matematiske Svenske Svante August Arrhenius (1859-1927) foreslog i 1884 følgende begreber til at definere syrer og baser:

Så generelt har vi:
H+ + H2O → H3O+
Eksempler:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NEJ3-
H2KUN4+ 2H2O → 2H3O+ + OS42-

Eksempler:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
Brönsted-Lowry teori:
Uafhængigt danske Johannes Nicolaus Brönsted (1879-1947) og engelskmanden Thomas Martin Lowry (1874-1936) foreslog samme år en anden syrebaseteori kendt som Brönsted-Lowry Theory, som siger Følge:

I dette tilfælde betragtes hydrogenionen som en proton. Dette ses i den følgende reaktion, hvor hydrocyansyre donerer en proton til vand, som derfor fungerer som en base:
HCN + H2O → CN- + H3O+
Denne reaktion er reversibel med hydroniumionen (H.3O+) kan donere en proton til CN-ionen-. Hydroniumionen (H3O+fungerer som en syre og CN- som base.
CN- + H3O+→ HCN + H2O
Lewis-teori:
Denne teori blev skabt af den amerikanske kemiker Gilbert Newton Lewis (1875-1946) og siger følgende:

Denne teori introducerer et nyt koncept, er mere omfattende, men ugyldiggør ikke Brönsted-Lowry-teorien. For hver Lewis-syre er en Brönsted-syre, og derfor er enhver Lewis-base en Brönsted-base. Dette skyldes, at en proton modtager elektroner, hvilket betyder, at en Lewis-syre kan slutte sig til et ensomt par elektroner i en Lewis-base.
For Lewis består en syre-base-reaktion af dannelsen af en mere stabil koordineret kovalent binding. Så når en Lewis-base donerer et par elektroner til en Lewis-base, danner de begge en koordinere kovalent binding, hvor begge elektroner kommer fra et af atomerne, som i eksemplet bælge:
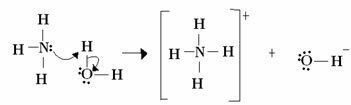
I dette tilfælde fungerer ammoniak som Lewis- og Brönsted-basen, da den donerer sine to elektroner til protonen og derfor er modtager af protonen. Derudover blev der dannet en kovalent binding mellem hydrogen (protonen) og ammoniak.
Vand er Lewis-syre og Brönsted-syre, da det donerer protonen og modtager elektroner, bemærk hvordan iltet i hydroxidet dannet af vand har et ekstra par elektroner.

Af Jennifer Fogaça
Uddannet i kemi
Brazil School Team.
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm



