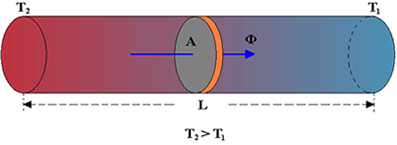
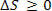Den første lov om termodynamik handler om, hvad der kræves for at arbejde kan omdannes til varme.
Det er baseret på princippet om energibesparelse, som er et af de vigtigste principper for fysik.
Denne energibesparelse finder sted i form af varme og arbejde. Det gør det muligt for et system at spare og overføre energi, dvs. energi kan øges, falde eller forblive konstant.
Den første lov om termodynamik udtrykkes med formlen
Q = τ + ΔU
Hvor,
Q: varme
τ: arbejde
U: variation af intern energi
Dermed er dets fundament: varme (Q) er resultatet af summen af arbejde (τ) med variationen af intern energi (ΔU).
Det kan også findes som følger:
ΔU = Q - W
Hvor,
U: variation af intern energi
Q: varme
W: arbejde
Fundamentet resulterer i det samme: ændringen i intern energi (ΔU) skyldes varme, der udveksles med det eksterne medium minus det udførte arbejde (W).
Det betyder,
1) som for varme (Q):
- Hvis den varme, der udveksles med mediet, er større end 0, modtager systemet varme.
- Hvis varmen, der udveksles med mediet, er mindre end 0, mister systemet varmen.
- Hvis der ikke er nogen varmeveksling med mediet, dvs. hvis det er lig med 0, modtager eller mister systemet hverken varme.
2) vedrørende arbejde (τ):
- Hvis arbejdet er større end 0, udvides volumenet af noget, der udsættes for varme.
- Hvis arbejdet er mindre end 0, reduceres volumenet af noget, der udsættes for varme.
- Hvis der ikke er noget arbejde, det vil sige, hvis det er lig med 0, er volumenet på noget, der udsættes for varme, konstant.
3) med hensyn til variationen af intern energi (ΔU):
- Hvis den interne energivariation er større end 0, er der en stigning i temperaturen.
- Hvis den interne energivariation er mindre end 0, er der et fald i temperaturen.
- Hvis der ikke er nogen ændring i intern energi, dvs. hvis den er lig med 0, er temperaturen konstant.
Det konkluderes, at temperaturen kan øges med varme eller med arbejde.
Eksempel
Opvarmning af gasser får maskinerne til at starte, det vil sige f.eks. Udføre arbejde i et anlæg.
Dette sker på følgende måde: gasserne overfører energi inde i maskinerne, hvilket får dem til at stige i volumen og derfra aktivere maskinernes mekanismer. Når aktiveret, begynder mekanismerne at virke.
Læs også
- Termodynamik
- Carnot cyklus
- Hess 'lov
Lov om termodynamik
Lovene om termodynamik er fire. Ud over den første, som vi har at gøre med, er der:
- Nul lov om termodynamik - beskæftiger sig med betingelserne for at opnå termisk ligevægt;
- Anden lov om termodynamik - beskæftiger sig med overførsel af termisk energi
- Tredje lov om termodynamik - beskæftiger sig med opførsel af stof med entropi tæt på nul.
Øvelser
1. (Ufla-MG) I en reversibel gasformig transformation er variationen af den indre energi + 300 J. Der var kompression, og arbejdet udført af gassens tryk er i modul 200 J. Så det er sandt, at gas
a) gav 500 J varme til mediet
b) gav 100 J varme til mediet
c) modtog 500 J varme fra mediet
d) modtog 100 J varme fra mediet
e) gennemgik en adiabatisk transformation
Alternativ d: modtog 100 J varme fra midten
Se også: Øvelser på termodynamik
2. (MACKENZIE-SP) Hold en smal åbning i munden, blæs din hånd kraftigt nu! Det så? Du har produceret en adiabatisk transformation! I den gennemgik den luft, du udviste, en voldsom ekspansion, hvorunder:
a) det udførte arbejde svarede til faldet i den indre energi i denne luft, da der ikke var nogen varmeudveksling med det eksterne miljø
b) det udførte arbejde svarede til stigningen i den indre energi i denne luft, da der ikke var nogen varmeudveksling med det eksterne miljø
c) det udførte arbejde svarede til stigningen i mængden af varme, der udveksles af denne luft med mediet, da der ikke var nogen variation i dens indre energi;
d) der blev ikke udført arbejde, da luften ikke absorberede varme fra miljøet og ikke led nogen variation i intern energi;
e) der blev ikke udført noget arbejde, da luften ikke gav varme til mediet og ikke led nogen ændring i intern energi.
Alternativ a: det udførte arbejde svarede til reduktionen af den indre energi i denne luft, da der ikke er nogen varmeudveksling med det eksterne miljø.
Se også: adiabatisk transformation