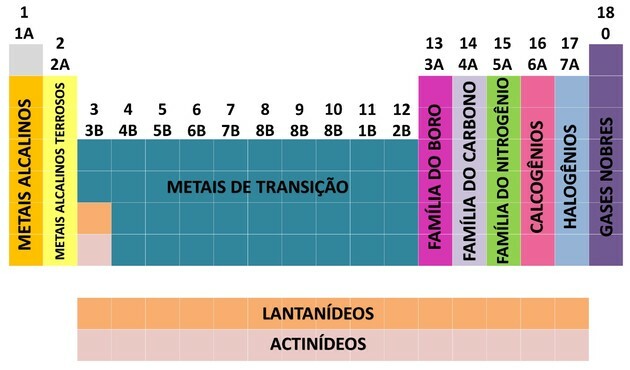
En af måderne, hvorpå kemiske grundstoffer organiseres, er gennem familier, der svarer til de lodrette sekvenser i det periodiske system.
På 18 kolonner i tabellen grupperer elementerne efter ligheder i kemiske egenskaber.
Organisering af kemiske grundstoffer i familier var en praktisk måde at strukturere de forskellige oplysninger, der blev fundet, og præsentere dem på en enkel måde.
For at lette placeringen af et kemisk element blev familierne udpeget i tal fra 1 til 18 som vist nedenfor:
Gennem bidrag fra mange forskere og forskellige forsøg på at arrangere dataene, udviklede det periodiske system sig og etablerede en ordre om at arrangere elementerne.
Nomenklatur for familier
- Familierne i tabellen blev opdelt i A (repræsentativ) og B (overgang), idet de blev identificeret med bogstaver og tal.
- Du repræsentative elementer familier 0, 1A, 2A, 3A, 4A, 5A, 6A og 7A svarer.
- Du overgangselementer familierne 1B, 2B, 3B, 4B, 5B, 6B, 7B og 8B svarer.
- Ved bestemmelse af Den Internationale Union for ren og anvendt kemi (IUPAC) blev familierne identificeret i grupper fra 1 til 18.
Periodisk system og elektronisk distribution
Lighederne mellem elementerne i den samme familie opstår, fordi antallet af atomens valenselektroner i jordtilstanden er det samme for medlemmerne af en bestemt gruppe.
For eksempel:
| Gruppe 1 | Elektronisk distribution |
|---|---|
| 3Læs | 2-1 |
| 11På | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Gruppe 1-atomer har deres elektroner fordelt over mere end et energiniveau, men alle har et valenselektron.
Med det observerer vi, at det at gøre elektronisk fordeling af atomet i jordtilstanden, finder vi dets position på det periodiske system.
repræsentative elementer
Repræsentative elementer udviser relativt mindre kompleks kemisk adfærd end overgangselementer og danner de fleste af stofferne omkring os.
Nogle af de repræsentative elementfamilier får specielle navne som vist nedenfor:
Gruppe |
Familie | specifikt navn | Navn oprindelse | Elementer | elektronisk konfiguration |
|---|---|---|---|---|---|
| 1 | 1A | alkalimetaller | fra latin alkali, hvilket betyder "gråt af planter". | Li, Na, K, Rb, Cs og Fr | os1 |
| 2 | 2A | jordalkalimetaller | Udtrykket "jordisk" henviser til "eksisterende på jorden". | Vær, Mg, Ca, Sr, Ba og Ra | os2 |
| 13 | 3A | borfamilie | Navnet på det første element i familien. | B, Al, Ga, In, Tl og Nh. | os2np1 |
| 14 | 4A | kulstof familie | Navnet på det første element i familien. | C, Si, Ge, Sn, Pb og Fl. | os2np2 |
| 15 | 5A | Kvælstoffamilie | Navnet på det første element i familien. | N, P, As, Sb, Bi og Mc. | os2np3 |
| 16 | 6A | Chalcogens | fra græken khalks, da de er elementer, der findes i kobbermalm. | O, S, Se, Te, Po og Lv. | os2np4 |
| 17 | 7A | Halogener | Græsk udtryk betyder saltdannere. | F, Cl, Br, I, At og Ts. | os2np5 |
| 18 | 0 | Ædle gasser | Det blev anset for ikke at reagere med andre stoffer. | Han, Ne, Ar, Kr, Xe, Re og Og. | 1s2 (Han) eller os2np6 |
Gennem tabellen kan vi se, at:
- Elementerne præsenteret ovenfor er klassificeret som repræsentative, fordi de har den mest energiske elektron i et s- eller p-underniveau.
- Elektroner fordeles over energiniveauer, og n repræsenterer atomets yderste niveau i jordtilstanden.
- De repræsentative elementer hører ifølge IUPAC's anbefaling til grupperne eller familierne 1,2,13,14,15,16,17 og 18.
O hydrogen det er klassificeret bortset fra de andre elementer. Selv med 1s elektronisk konfiguration1, han er ikke en del af gruppe 1 for at præsentere en enestående adfærd.
overgangselementer
Overgangselementerne svarer til gruppe 3 til 12. De får dette navn, fordi de har mellemliggende egenskaber mellem gruppe 1 og 2 og de repræsentative ikke-metalliske elementer.
Du overgangsmetaller er defineret af IUPAC som:
Et overgangselement har et ufuldstændigt d-underniveau eller kan danne kationer med et ufuldstændigt d-underniveau.
Når atomets mest energiske elektron i jordtilstand er i et ufuldstændigt d-underniveau, karakteriseres det som en ekstern overgang.
Lanthanider og actinider er interne overgangselementer, da de har mindst et ufuldstændigt f-underniveau.
Når elementerne har elektroner, der fylder d- eller f-orbitalerne, udviser de lignende egenskaber og kan klassificeres i elementer af ydre eller indre overgang.
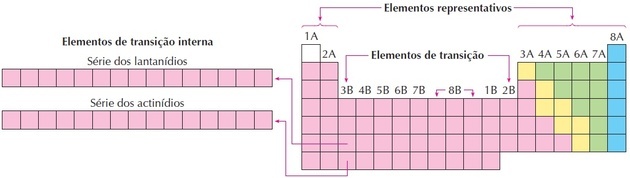
Som vi kan se på billedet svarer familie 8B til 3 kolonner, de er grupper 8, 9 og 10, som blev grupperet sådan, fordi de har lignende egenskaber.
Hovedkarakteristika for familier
Tabellen nedenfor viser de vigtigste egenskaber for grupperne i det periodiske system:
| Gruppe | Funktioner | sammensatte stoffer mere normalt |
forekomster |
|---|---|---|---|
| 1 | Solid og skinnende under omgivende forhold. Meget reaktive, bløde og gode ledere af elektricitet. | Salte, hydroxider og oxider |
Reager med halogener og dann salte. |
| 2 | Mindre reaktive og hårdere end gruppe 1. Sølvfaststoffer med god ledningsevne. | Salte, hydroxider og oxider |
Dannelse af salte og oxider. |
| 3 til 12 | De danner komplekser. De er faste stoffer af metal, hårde og sprøde, med undtagelse af kviksølv, som er en væske. | Salte, oxider og komplekser. Eks: AgNO3, TiO og [Cr (OH)3(H2O)3] |
I mineraler i form af oxider. |
| 13 | Tørstof i omgivende forhold, sølv undtagen bor. | Oxider Eks: B2O3 |
I mineraler i form af oxider. |
| 14 | Fast under omgivende forhold. | Atomer af C og Si kan ordne sig i kæder og producere et stort udvalg af stoffer. | I levende organismer og i form af silicater eller oxider. |
| 15 | Tørstof, undtagen nitrogen, som er luftformigt under omgivelsesbetingelser. | Oxider og syrer Eks: NEJ2 og H3STØV4 |
Atmosfære, levende organismer og mineraler. |
| 16 | Tørstof, undtagen ilt, som er luftformigt under omgivelsesbetingelser. | Sulfider og oxider Eks: ZnS og SiO2 |
Atmosfære, levende organismer og mineraler. |
| 17 | De danner diatomiske molekyler og er meget reaktive. De er dårlige ledere af elektricitet og varme. De er aggressive over for levende væsener og miljøet. | Syrer og salte. Eks: HCl og KBr |
Er til stede i stoffer organisk og mineralsk. |
| 18 | De er meget stabile og findes i form af gasser. | De danner næppe sammensatte stoffer. | Gasser i atmosfæren. |
Kemiske og fysiske egenskaber adskiller en familie fra en anden. Som vi har set, er kemiske egenskaber relateret til elektroner af valens, og gennem dem interagerer et atom med et andet, der er ansvarlig for den kemiske adfærd og kemiske bindinger dannet.
Elementernes fysiske egenskaber i den samme gruppe kan variere alt efter atomnummer og masse.
Øvelser
Nu hvor du ved lidt mere om periodiske systemfamilier, skal du teste din viden og se, hvad du har lært.
1) Overvej følgende uddrag fra det periodiske system.
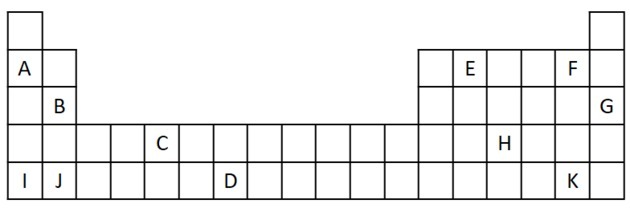
a) Benævn to elementer, der har to valenselektroner.
b) Angiv et element, der reagerer voldsomt med vand og frembringer et metalhydroxid.
c) Angiv et ikke-reaktivt element.
d) Angiv to grundstoffer, der kombineres med alkalimetaller for at danne salte.
Svar:
a) B og J
To valenselektroner svarer til gruppe 2, som har en ns-elektronkonfiguration2 og er repræsenteret i øvelsen af B og J.
b) A, B, I eller J.
A og I repræsenterer elementer i familie 1; B og J er fra familie 2. Som vi så i egenskabstabellen, er gruppe 1 og 2-elementer meget reaktive og kan danne hydroxider, som i de givne eksempler: KOH og Mg (OH)2.
c) G
Ædelgasser er meget stabile og derfor ikke særlig reaktive. Bogstavet G indsættes i tabellen som et element i denne familie.
d) F og K
Halogener reagerer med alkalimetaller for at danne salte. Det mest almindelige eksempel på dette er bordsalt, NaCl.
2) Følgende figur viser tre kemiske grundstoffer, fra venstre mod højre, lithium, natrium og kalium.

Vælg den indstilling, der korrekt udfylder hvert af følgende udsagn.
1.1) "Vi kan sige, at lithium, natrium og kalium ...
(A)... tilhører samme periode. ”
(B)... har samme atomnummer. ”
(C)… tilhører den samme gruppe. ”
(D)… har samme massenummer. ”
1.2) "Elementerne lithium, natrium og kalium ...
(A)... har meget lignende kemiske egenskaber. ”
(B)... har meget forskellige kemiske egenskaber. ”
(C)… er ikke-metaller. ”
(D)... reagere med vand til dannelse af sure opløsninger. ”
Svar:
1.1) (C) hører til den samme gruppe.
1.2) (A) har meget lignende kemiske egenskaber.
Vi kan få disse oplysninger ved at konsultere det periodiske system eller ved at foretage den elektroniske distribution af grundstofferne lithium, natrium og kalium. Vi vil se, at de tre har en elektron i valensskallen, og fordi de er en del af den samme gruppe, er de kemiske egenskaber meget ens.
3) Overvej følgende tabel, hvor atomnumre og elektroniske fordelinger af nogle kemiske grundstoffer er repræsenteret.
| Element | kemisk symbol | Atom nummer | Elektronisk distribution |
|---|---|---|---|
| Lithium | Læs | 3 | 2,1 |
| Beryllium | være | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Huh | 10 | 2,8 |
| klor | Cl | 17 | 2,8,7 |
| argon | Luft | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Kalk | Her | 20 | 2,8,8,2 |
Angiv gruppen for hvert element.
Svar:
Lithium og kalium: gruppe 1. (De har en elektron i valensskallen).
Beryllium og calcium: gruppe 2. (De har to elektroner i valensskallen).
Fluor og klor: gruppe 17. (De har syv elektroner i valensskallen).
Neon og argon: gruppe 18. (De har otte elektroner i valensskallen).
Tjek spørgsmål til optagelseseksamen med en kommenteret opløsning i Øvelser på det periodiske system og upublicerede spørgsmål om emnet i Øvelser i organisering af det periodiske system.