definerer sig selv som hybridisering foreningen af ufuldstændige atomorbitaler. En orbital klassificeres som ufuldstændig, når den kun har en elektron inde i stedet for to. Se en gengivelse af en ufuldstændig orbital og en komplet orbital:

I billede A har vi en komplet orbital; i billede B, en ufuldstændig orbital.
Hybridisering er et naturligt fænomen, der forekommer med nogle kemiske grundstoffer, såsom fosfor, svovl, kulstof osv. Hybridiseringen af kulstof tillader at dette grundstofs atomer er i stand til at danne fire kemiske bindinger, det vil sige kulstof udgør kun fire bindinger efter at have gennemgået fænomenet hybridisering.
Men hvorfor hybridiserer kulstof og danner fire bindinger? For at forstå dette fænomen er vi nødt til at kende den elektroniske distribution af dette element:
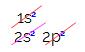
I den elektroniske distribution af kulstof ser vi, at 1s-underniveauet er komplet (med to elektroner), 2s er komplet (med to elektroner) og 2p-underniveauet er ufuldstændigt (p-underniveauet understøtter seks elektroner, men der er kun to). Når vi distribuerer 2p-elektronerne på en repræsentativ måde, skal vi:
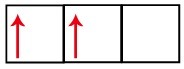
P-underniveauet har tre orbitaler - i tilfælde af kulstof er to af dem ufuldstændige og en er tom. Af denne grund bør dette element kun udføre to links, da antallet af ufuldstændige orbitaler altid bestemmer antallet af links.
Men når de modtager energi fra det eksterne miljø, er elektronerne, der er til stede i kulstof, ophidset. Således bevæger en af elektronerne, der er til stede i underniveau 2s, til kredsløbets underniveau p, der var tom:
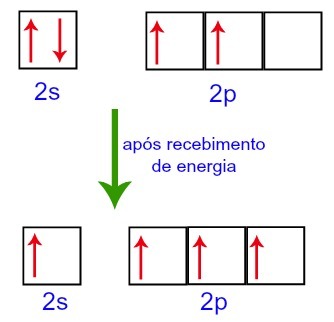
Carbon Orbitals før og efter modtagelse af energi fra det eksterne miljø
Således er kulstof tilbage med fire ufuldstændige orbitaler på sit andet niveau. Derefter forbinder 2s subniveauets orbital de tre p-orbitaler, som konfigurerer fænomenet hybridisering.
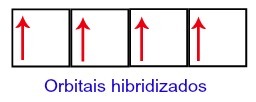
Carbon orbitaler efter hybridisering
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm