Elementerne opkaldt efter jordalkalimetaller er dem, der hører til familie 2 eller IIA i det periodiske system. En sådan gruppe omfatter følgende kemiske grundstoffer: Være (Beryllium), Mg (Magnesium), Ca (Calcium), Sr (Strontium), Ba (Barium) og Radium (Ra).

De har to elektroner i valensskallen, og deres generiske fordeling er repræsenteret af ns2, hvor ingen repræsenterer nummeret på det sidste niveau. På grund af denne egenskab har de en tendens til at miste disse to elektroner, hvilket giver anledning til 2+ ladningskationer.
Udtrykket "jord" henviser til "eksisterende på jorden", da det er her disse grundstoffer findes, hovedsageligt i mineraler. For eksempel calcium i form af calciumphosphatforbindelsen (Ca3(STØV4)2), findes i jordskorpen og tjener som råmateriale til produktion af fosfor. Det er også til stede i dyrenes knogler, så meget, at når disse kalcineres, opnås det såkaldte ”knoglemel”, der indeholder calciumphosphat.
Blandt de jordalkalimetaller er de, der skiller sig mest ud Kalk Det er Magnesium.
- Kalk
Calciumionen (Ca2+) er til stede i ca. 90% af vores knogler og tænder; og hos dyr er det også til stede i deres skaller. Dens funktion er at styrke knoglestrukturen og fungere som et muskelafslappende middel. Mangel på calcium i kroppen kan forårsage muskelkramper, stivkrampe og osteoporose. Derfor er det vigtigt at spise det gennem mad rig på calcium, såsom mælk og dets derivater (smør, ost osv.), Kød og grøntsager.
På den anden side kan for meget calcium forårsage muskelafslapning, nyresten og knoglesmerter.
Ud over de førnævnte fødevarer er calcium stadig til stede i mange dele af naturen, især i mineraler såsom calcit (CaCO3) eller calciumcarbonat, som er en bestanddel af kalksten og marmor, og marmor bruges til fremstilling af dræn, statuer, gulve og trapper. Calciumcarbonat er også bygherre af stalaktitter og stalagmitter i huler. Calcium er også til stede i naturligt gips (CaSO4. 2 timer2O), kaldet gips. Dette salt kan dehydreres, hvilket giver anledning til CaSO4 vandfri, som er skolekridt.
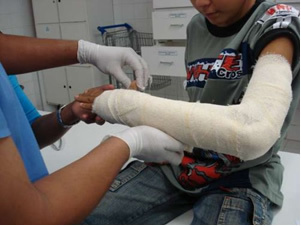
I industrien produceres jomfru kalk (CaO), slækket kalk, også kaldet hydreret kalk eller slækket kalk, som faktisk er calciumhydroxid (Ca (OH))2), der anvendes til hvidkalkning og til fremstilling af mørtel. Den blide opvarmning af gipsen gør det muligt at opnå det hemihydrerede calciumsulfat, som er gips, der anvendes i byggeriet civilsamfundet, i produktionen af skimmelsvampe inden for tandpleje og medicin for at beskytte knoglebrud, som den i armen vist nedenfor.
- Magnesium
ionen af magnesium det har også stor biologisk betydning, da det er til stede i 70% af vores knogler, hvilket favoriserer virkningen af enzymer, muskler og motorisk koordination. Dens mangel på kroppen kan forårsage desorientering, hypertension, rysten og en svag puls. Derfor bør vi spise følgende fødevarer, der indeholder dette element: nødder, korn og grønne grøntsager. Også overskydende magnesium i kroppen kan forårsage døsighed.
Magnesium findes også i havvand og mineraler. Det bruges i metalliske legeringer, såsom offermetaller (som oxiderer i stedet for stål og forhindrer korrosion), i "magnesium" hjul og i fyrværkeri (tilbyder farverne sølv og hvid). En meget vigtig forbindelse af magnesium er magnesiumhydroxid (Mg (OH))2), som når dispergeret i vand i en koncentration på ca. 7% giver anledning til en kendt suspension populært som magnesia mælk, der tjener som et syrenøytraliserende middel, der kæmper mod mavesyre (halsbrand) og som afføringsmiddel.

Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm
